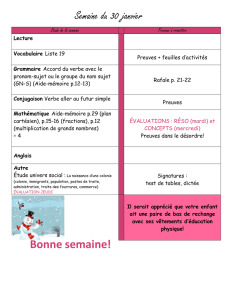
Critères cliniques pour le des DM remboursement

74
Conseil | Etudes et évaluations cliniques
DeviceMed France | Mars-Avril 2012 | www.devicemed.fr
i
Critères cliniques pour
le remboursement des DM
La valeur méthodologique des études cliniques a pris une place centrale dans
l’évaluation des produits de santé. Les méthodes et le design d’étude tendent
à devenir identiques pour les médicaments et les dispositifs médicaux. Le
point sur les critères d’évaluation des autorités compétentes.
Antoine Disset, consultant
T
out comme les médicaments, les
dispositifs médicaux doivent être
évalués tout au long de leur dévelop-
pement pour leur mise au point tech-
nologique, mais aussi afin de démon-
trer leur performance et leur bénéfice
pour le patient.
Depuis le constat du manque de
preuves scientifiques et suite à la sup-
pression des avis d’expert dans
l’évaluation finale, l’apport d’études
cliniques est devenu une condition
systématique dans la prise de décision
des autorités compétentes. De plus, la
volonté de la CNEDiMTS et du CEPS
ont rendu l’accès aux marchés fran-
çais plus rigoureux avec des deman-
des d’études de qualité de plus en plus
nombreuses et des engagements cli-
niques obligatoires. Les méthodes et
le design d’étude doivent obéir à un
certain nombre de critères devenus
essentiels dans l’évaluation des pro-
duits de santé.
Design d’étude et calcul du
nombre de patients
L’argumentation du rapport bénéfice
/ risque dans les dossiers de demande
de remboursement doit être fondée sur
la présentation de données cliniques
spécifiques, pertinentes et valides Le
choix du type d’étude retenue pour
apporter les éléments jugés utiles à
l’évaluation doit être justifié. En effet,
dans le développement d’un produit,
le choix du design des études doit être
stratégiquement élaboré afin d’appor-
ter les preuves cliniques, la validation
de ces preuves ainsi que la place d’un
produit par rapport à la stratégie de
référence. Ces preuves peuvent prove-
nir d’essais contrôlés randomisés, de
méta-analyses ou d’études transver-
sales. Le choix du design et le calcul
du nombre de patients doivent être
réalisés de manière rigoureuse afin
d’obtenir une puissance suffisante qui
mènera à des résultats indiscutables.
L’importance des biais et
des choix méthodologiques
La valeur méthodologique dépend de
la qualité de l’étude - représentée par
le choix du design - et des biais métho-
dologiques associés. On parle de biais
lorsque la différence observée entre
deux groupes de traitement à la fin de
l’essai est due à un autre facteur que le
traitement étudié. On distingue des
biais à diverses étapes d’une étude : lors
de la sélection des patients, de l’exécu-
tion du traitement, de l’exclusion et des
sorties d’étude ainsi que dans l’évalua-
tion du critère de jugement. Un proto-
cole d’étude bien pensé et un suivi ri-
goureux pendant la durée de l’étude
limitent les biais méthodologiques et
les limites statistiques. L’argumenta-
tion reposera sur l’évaluation d’un
critère de jugement principal. Des cri-
tères de jugements secondaires pour-
ront être utilisés. Les critères de juge-
ments pertinents sont des critères cli-
niques, de préférence en terme d’effet
sur la mortalité/morbidité, la qualité
de vie ou la compensation du handi-
cap, et correspondent à ceux préconi-
sés par l’état de l’art. Si ce n’est pas le
cas, une argumentation devra être
fournie pour justifier leur choix.
Ainsi, le niveau de preuve scienti-
fique d’une étude clinique dépend de
son design, de la qualité et de la valeur
statistique du résultat, associés aux
degrés de biais méthodologiques. A
noter que la valeur méthodologique
d’une étude est évaluée avant ses ré-
sultats, qui ne pourront être considé-
rés comme indiscutables qu’à partir
d’un niveau de preuves scientifiques
suffisant.
AD-DM Consulting
F-34000 Montpellier
www.ad-dmconsulting.com
DMF_Mar12_p74-76_EG1.indd 74 05.03.12 18:38
1
/
1
100%