Ganglion sentinelle et cancer colorectal MISE AU POINT

314 | La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008
MISE AU POINT
Ganglion sentinelle
et cancer colorectal
Sentinel lymph node in colorectal cancer
I. Elghissassi*, O. El Mesbahi*, H. Inrhaoun*, S. Vignot**, H. Errihani*
* Service d’oncologie médicale, Institut
national d’oncologie, Rabat, Maroc.
** Service d’oncologie médicale,
groupe hospitalier Diaconesses-Croix-
Saint-Simon, Paris.
Méthodes
Cette revue de la littérature, issue des réflexions en
vue du développement des techniques d’analyse des
ganglions sentinelles à l’Institut national d’oncologie
de Rabat, a été réalisée à partir d’une recherche
bibliographique sur Medline. Les mots-clés choisis
sont sentinel lymph node et colorectal cancer. Les
articles originaux présentant les techniques chirur-
gicales, les résultats de faisabilité et les données
d’évaluation du pronostic ont été préférentiellement
sélectionnés. Seuls les articles de langue française
ou anglaise ont été retenus.
Intérêt stratégique
du prélèvement du ganglion
sentinelle
Le carcinome colorectal est le cancer digestif le
plus fréquent (36 200 nouveaux cas en France en
2000 [1]). Outre l’atteinte de la paroi et la présence
d’emboles veineux, l’envahissement ganglionnaire est
un élément pronostique significatif dans les cancers
colo-rectaux. Alors que les patients classés stade I
de l’American Joint Committee on Cancer (AJCC)
ont une survie à 5 ans de 90 %, ce taux descend
à 75 % pour les stades II, et à 50 % pour les stades III
avec atteinte ganglionnaire (2). Toutefois, un tiers
des patients sans atteinte ganglionnaire à l’examen
anatomopathologique standard présenteront une
récidive métastatique (3). Cette donnée, potentiel-
lement corrélée à d’autres marqueurs d’agressivité,
pourrait également indiquer une insuffisance de
l’analyse histologique de routine, qui sous-estimerait
les métastases ganglionnaires. Celles-ci sont souvent
localisées au niveau des sinus sous-capsulaires du
ganglion lymphatique et peuvent passer inaperçues
aux examens anatomopathologiques convention-
nels limités à une ou deux sections (4). La déter-
mination de l’envahissement ganglionnaire dans les
cancers colorectaux est non seulement un facteur
pronostique prédominant, mais aussi un élément
décisionnel pour la chimiothérapie adjuvante. Il
devient alors important d’augmenter la sensibi-
lité des techniques de détection, en augmentant
le nombre de coupes réalisées par ganglion ou en
utilisant des techniques d’immunohistochimie ou de
biologie moléculaire. Ces procédures sont toutefois
longues et coûteuses quand elles doivent concerner
l’ensemble des prélèvements ganglionnaires de la
pièce opératoire (5, 6). La technique du ganglion
sentinelle, initialement développée dans la prise en
charge des cancers péniens (7) et des mélanomes (8)
puis des cancers du sein (9), pourrait permettre en
chirurgie colorectale un examen ciblé conduisant
à une approche plus efficace et moins coûteuse de
la détection de l’envahissement ganglionnaire. Elle
ne se présente pas comme une alternative moins
invasive au curage standard, comme cela a été
rapporté dans les cas du mélanome et du cancer
du sein. En effet, la morbidité surajoutée du curage
ganglionnaire dans la prise en charge des cancers
colorectaux est faible. La technique du ganglion
sentinelle pourrait également être utilisée pour iden-
tifier un drainage lymphatique aberrant, ce qui arrive
dans 2 % à 14 % des cancers colorectaux (10). Le
ganglion sentinelle résultant d’un drainage lympha-
tique anormal pourrait être le seul ganglion positif
alors que les ganglions du curage classique sont
négatifs (11). Cette donnée peut également devenir
essentielle lorsqu’on envisage une chimiothérapie
adjuvante.

La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008 | 315
Résumé
La technique du ganglion sentinelle, développée initialement dans la prise en charge des cancers péniens et des méla-
nomes puis dans celle des cancers du sein, s’étend maintenant à d’autres localisations tumorales. Son prélèvement,
par une technique peu invasive, et son analyse histologique ciblée pourraient permettre une amélioration de la stadi-
fication, tout en réduisant la morbidité liée au curage ganglionnaire. Pour les cancers colorectaux non métastatiques,
l’importance de la notion d’envahissement ganglionnaire dans la décision d’instaurer une chimiothérapie adjuvante
pourrait justifier l’utilisation de cette technique afin de mettre en évidence, grâce à un examen plus ciblé, d’éventuelles
micrométastases ayant échappé aux méthodes usuelles. Cette revue de la littérature propose de détailler les modalités
de prélèvement du ganglion sentinelle dans la chirurgie des cancers colorectaux et de présenter les premiers résultats
de faisabilité de cette technique. Les données actuelles permettent maintenant de définir les techniques les plus appro-
priées en vue de l’analyse des ganglions sentinelles, tant sur le plan des modalités de prélèvement chirurgical que sur
celui de l’analyse histologique moléculaire, mais l’impact potentiel de cette approche sur la stratégie de traitement
adjuvant reste à définir.
Mots-clés
Cancer colorectal
Ganglion sentinelle
Micrométastases
Highlights
Sentinel lymph node biopsy
was initially developed in
penile cancer and melanoma
then in breast cancer and
is now considered for other
cancer types. The sentinel
lymph node detection and the
targeted pathological exami-
nation could improve cancer
stadification and decrease
the morbidity of lymph node
dissection. For nonmetastatic
colorectal cancers, the impor-
tance of nodal involvement
on the decision of adjuvant
chemotherapy could justify this
procedure. Sentinel lymph node
detection allows more precise
pathological examination and
could reveal micrometastases
which are not detected with
usual techniques. This review
of the literature details the
methods of sentinel lymph
node biopsy in colorectal cancer
surgery and presents the feasi-
bility results of this technique.
Current data allow defining the
most accurate techniques for
sentinel lymph node analysis
in colorectal cancer, conside-
ring surgical methods as well
as pathological analysis, but
the potential impact of this
approach on adjuvant treat-
ments remains to be defined.
Keywords
Colorectal cancer
Sentinel lymph node
Micrometastasis
Techniques de prélèvement
du ganglion sentinelle
Techniques chirurgicales
Détermination peropératoire ◆
A.B. Bilchik et al. ont décrit la méthode permettant
le prélèvement des ganglions sentinelles pendant
l’intervention chirurgicale. Après vérification de la
résécabilité de la tumeur au cours de l’exploration
abdominale, le segment colique considéré est immo-
bilisé. À l’aide d’une seringue à tuberculine, 1 ml de
bleu d’isosulfan est injecté en sous-séreux au niveau
des quatre quadrants à la périphérie de la tumeur.
Depuis le site d’injection, en parcourant les vais-
seaux lymphatiques, le colorant atteint le ganglion
sentinelle en 30 à 60 secondes. Il peut être néces-
saire de réaliser une dissection fine du mésocôlon
pour repérer les trajets lymphatiques aboutissant
aux ganglions sentinelles. La colectomie est alors
réalisée par chirurgie conventionnelle ou sous lapa-
roscopie, tous les ganglions repérés auparavant par
un fil étant emportés. On retrouve habituellement
1 à 4 ganglions sentinelles (12).
Détermination après résection, sur la pièce ◆
isolée
Le prélèvement des ganglions ex vivo (colorant injecté
et repérage effectué après la résection de la pièce de
colectomie) peut être fait d’emblée ou après échec
de l’identification du ou des ganglions sentinelles
en peropératoire. Cette technique présente l’avan-
tage d’injecter directement le colorant sous contrôle
visuel, et évite ainsi certains échecs en rapport avec
des injections intraluminales. Aussi, contrairement
à la détermination peropératoire, la durée de la
procédure chirurgicale n’est pas augmentée par le
prélèvement ex vivo des ganglions sentinelles, ce qui
pourrait permettre d’éviter une morbidité potentielle
et une élévation du coût. Cependant, l’inconvénient
majeur de cette technique est qu’elle ne permet pas
de détecter un éventuel drainage lymphatique aber-
rant situé en dehors de la pièce de résection. Après
ouverture de la pièce opératoire, 0,5 à 2 ml de bleu
d’isosulfan sont injectés en sous-séreux ou en sous-
muqueux à la périphérie de la tumeur. Le colorant
est visualisé à travers les vaisseaux lymphatiques
jusqu’à identification des ganglions sentinelles avant
que soit réalisée la fixation du spécimen chirurgical
(13, 14).
Apport de la coloscopie ◆
Une procédure alternative d’identification et de
prélèvement du ganglion sentinelle a été décrite
pour un repérage lors d’une coloscopie dans une
approche de résection laparoscopique des cancers
colorectaux. À l’aide d’un coloscope, 0,5 à 1 ml de
bleu d’isosulfan sont injectés dans la sous-muqueuse
péritumorale. La coloration bleue du site d’injec-
tion et des trajets lymphatiques efférents jusqu’au
premier relais ganglionnaire peut tout à fait être
visualisée avec le laparoscope. Chaque ganglion est
alors repéré à l’aide de fils ou de clips. La résec-
tion anastomose est effectuée, emportant tous les
ganglions bleus marqués. Cette technique est parfai-
tement réalisable en pratique et n’ajoute en moyenne
que 15 à 20 minutes à la résection colo rectale lapa-
roscopique (11). Une technique alternative a été
développée, fondée sur un tatouage préopératoire
de la tumeur par coloscopie permettant son repé-
rage lors de la laparoscopie. L’injection de bleu se
fait alors par voie percutanée, avec une aiguille de
rachianesthésie, sous contrôle vidéo (11).
Colorant ou lymphoscintigraphie ?
La plupart des études ont été menées en utilisant
exclusivement le colorant bleu d’isosulfan. Cepen-
dant, certains patients pouvant avoir un drainage
lymphatique difficilement détectable, certains
auteurs ont utilisé également un radiotraceur
afin d’améliorer les taux d’identification (15). En
pratique clinique, dans la chirurgie des cancers
colorectaux, l’utilisation d’un colloïde radioactif
poserait des problèmes. Les contraintes de radio-
protection rendent les injections péritumorales
difficiles (coloscopie préopératoire à réaliser en
service de médecine nucléaire), alors que le bleu
d’isosulfan est peu coûteux, facile à employer et
aisément repérable en peropératoire, car il circule
dans les vaisseaux lymphatiques mésentériques. La
tendance actuelle est donc à l’utilisation exclusive
du bleu (10).

316 | La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008
Ganglion sentinelle et cancer colorectal
MISE AU POINT
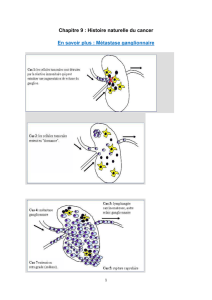
Analyse anatomopathologique
L’intérêt théorique de la technique du ganglion
sentinelle dans le cancer colorectal est de mettre
en évidence, grâce à un examen anatomopatho-
logique plus ciblé, des métastases occultes éven-
tuelles ayant échappé aux méthodes usuelles. Les
métastases occultes comprennent, d’une part, les
micrométastases définies par des cellules tumo-
rales dont le diamètre est compris entre 0,2 mm
et 2 mm et, d’autre part, les cellules tumorales
isolées qui peuvent être soit un groupement cellu-
laire de moins de 0,2 mm, soit des cellules tumo-
rales solitaires (16). En se focalisant sur l’analyse
des ganglions sentinelles, certaines techniques
d’immunohistochimie et de biologie moléculaire
deviennent plus accessibles en termes de temps
et de coût. Ces tests augmentent considérable-
ment le taux de détection des métastases occultes.
R.R. Turner et al. ont rapporté que l’immuno-
histochimie des cytokératines permet d’identi-
fier des cellules malignes dans 10 % des ganglions
sentinelles qui étaient négatifs en coloration stan-
dard. Ils recommandent cependant la prudence
lors de l’interprétation des résultats de cellules
qui ne sont positives qu’en immunohistochimie,
car celles-ci peuvent occasionnellement corres-
pondre à des cellules épithéliales bénignes ou à
des cellules mésothéliales hyperplasiques (17).
J.H. Wong et al. considèrent que, si l’examen histo-
logique des ganglions sentinelles est négatif en
coloration standard et en immunohistochimie,
la probabilité d’une atteinte des ganglions non
sentinelles est très faible (18). Dans leur étude
récente, W. Kelder et al. ont signalé un taux nul
de faux négatifs (ganglion sentinelle négatif alors
qu’au moins un des ganglions non sentinelles
est atteint) quand la RT-PCR est employée pour
détecter l’ARNm de l’antigène carcino-embryon-
naire (ACE) [19]. D’autres études ont rapporté que
des ganglions sentinelles histologiquement négatifs
selon les techniques de coloration traditionnelles
pourraient contenir des métastases occultes détec-
tables par RT-PCR identifiant une expression de
guanylate cyclase C (GCC), de cytokératine 20
(CK-20) ou de guanylyl (mesures qualitatives) [12].
Cependant, ces gènes peuvent être exprimés
dans certains tissus normaux, et l’analyse peut
aboutir à des faux positifs en l’absence de seuils
de niveau d’expression identifiés. Afin d’augmenter
la performance de la technique, la mise en place
d’un système de multimarqueurs semble nécessaire
pour la détection des micrométastases, permettant
de tenir compte de l’hétérogénéité tumorale, de
la variabilité clonale et de l’expression variée de
différents gènes. Ces associations de marqueurs
(immunohistochimie et/ou biologie moléculaire)
restent à définir.
Discussion
Faisabilité de la technique
Les excellents taux d’identification du ganglion
sentinelle rapportés dans les tumeurs mammaires
et dans le mélanome ont motivé le test de la faisa-
bilité de cette technique dans d’autres localisations
tumorales, notamment le cancer de la vulve (20),
le cancer du col (21) et le cancer colorectal. Afin de
comparer, dans les cancers colorectaux, la stadifica-
tion ganglionnaire obtenue par la chirurgie conven-
tionnelle ou par la technique du ganglion sentinelle,
S. Saha et al. ont mené une étude multicentrique non
randomisée portant sur deux groupes de patients
atteints de cancer colorectal entre 1996 et 2004.
Dans le groupe B, 368 patients ont subi une résec-
tion chirurgicale conventionnelle avec examen
anatomopathologique tandis que, dans le groupe A,
500 patients ont été opérés avec une technique de
repérage du ganglion sentinelle par injection de
1 à 3 ml de bleu d’isosulfan dans la sous-séreuse
péritumorale. Les 4 premiers ganglions bleus identi-
fiés dans les cinq minutes étaient considérés comme
des ganglions sentinelles, et étaient alors prélevés au
cours d’une résection chirurgicale standard. L’ana-
lyse focalisée des ganglions sentinelles comprenait
l’étude de coupes sériées de 20 à 30 μm d’intervalle
en coloration standard et en immunohistochimie
(CK). Les ganglions non sentinelles étaient examinés
selon les techniques standard. L’identification des
ganglions sentinelles était réussie chez 98 % des
patients. Même s’il s’agit d’une étude non rando-
misée, on notera que le nombre médian de ganglions
prélevés pour chaque patient était de 15 dans le
groupe A versus 12,2 dans le groupe B (p = 0,0001).
L’analyse des ganglions sentinelles permet une
augmentation significative du taux de détection
d’une atteinte ganglionnaire quel que soit le stade de
la tumeur (tableau I). Les métastases ont été détec-
tées uniquement par l’analyse conventionnelle des
ganglions sentinelles (mais avec des coupes sériées
plus nombreuses) dans 43 % des cas et seulement
par l’immunohistochimie dans 17 % des cas (22).
Une autre étude, menée par A.J. Bilchik et al. (12),
a concerné 100 patients présentant un carcinome
▸▸▸ / ▸▸▸

La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008 | 319
MISE AU POINT
colorectal primitif (tableau II). Son objectif était
d’évaluer la sensibilité, l’exactitude et la faisabilité
de la stadification de ces patients par un examen
ciblé et une analyse moléculaire des ganglions
sentinelles. Ceux-ci ont été repérés par injection
péritumorale de 1 ml de bleu d’isosulfan. Cette
cartographie était réussie dans 97 % des cas. L’en-
semble des ganglions de la pièce opératoire a été
examiné par la coloration de routine, tandis que les
ganglions sentinelles ont été analysés par des coupes
sériées, des techniques d’immunohistochimie et/
ou de RT-PCR afin d’identifier les micrométastases.
Vingt-six patients présentaient des ganglions consi-
dérés métastatiques selon la technique standard.
Sur 74 patients N–, 18 (24 %) présentaient des
micrométastases ganglionnaires non diagnostiquées
par l’examen courant mais détectées par l’analyse
histologique ciblée des ganglions sentinelles. On
notait 5 faux négatifs liés aux tumeurs T3/T4. Une
PCR étudiant les marqueurs ARNm (BHCG, C-Met
et uMAGE) a été réalisée chez 40 patients, dont
26 étaient considérés comme négatifs selon les
techniques classiques et l’immunohistochimie. Pour
12 de ces 26 patients (46 %), la biologie molécu-
laire a permis d’identifier des cellules évocatrices
de micrométastases.
La première étude prospective randomisée compa-
rant l’évaluation de la procédure du ganglion senti-
nelle et l’évaluation pathologique standard dans
les carcinomes coliques a été publiée récemment
par A. Stojadinovic et al. (23). Cet essai multi-
centrique a porté sur 161 patients présentant un
cancer colique primitif non métastatique durant
la période 2002-2006. Dans le premier bras, une
résection chirurgicale conventionnelle suivie d’une
évaluation histopathologique standard était réalisée
alors que, dans le deuxième bras, la technique du
ganglion sentinelle utilisant un colorant bleu ex vivo
était réalisée immédiatement en postopératoire,
ainsi qu’une analyse anatomopathologique par
sections multiples à 40 µm et une étude immu-
nohistochimique. Un ganglion sentinelle était
considéré comme positif en cas d’identification de
cellules tumorales isolées ou de groupement cellu-
laire à l’examen histologique standard ou immuno-
histochimique. Les résultats étaient en faveur de
la procédure du ganglion sentinelle, puisque cette
dernière a permis d’identifier plus de ganglions
envahis que dans le groupe contrôle (57,3 % versus
38,7 % ; p = 0,019) soit un ultrastaging de 19 %. Les
métastases ganglionnaires ont été détectées unique-
ment par l’analyse conventionnelle avec sections
multiples dans 10,7 % des cas. On note que, dans
cette étude, le taux de détection de la technique
du ganglion sentinelle était de 97,6 % et le taux de
faux négatifs de 9,8 %.
Ces travaux montrent que la technique du ganglion
sentinelle est faisable et qu’elle permet d’augmenter
le taux de détection de l’envahissement ganglion-
naire, ce qui conduit potentiellement à une meilleure
stadification pronostique. Toutefois, aucune de ces
trois études ne présente de données relatives à la
survie permettant de déterminer l’impact pronos-
tique de l’envahissement micrométastatique.
Le tableau III montre les résultats, dans les études
récentes, des taux de détection et de faux négatifs de
la technique du ganglion sentinelle dans les cancers
colorectaux.
Limites
Limites techniques ◆
Alors que les études princeps présentent des taux
élevés de réussite de la cartographie lymphatique
par injection de bleu d’isosulfan, en pratique, le taux
d’identification des ganglions sentinelles varie parmi
les différentes observations de la littérature. Pour
certains auteurs, il ne dépasse pas les 71 % (10),
taux certainement inférieur aux 97 % ou 98 %
Tableau II. Apport de l’analyse des ganglions sentinelles selon le stade tumoral (12).
Stade n N+
Analyse standard
N+
Analyse ciblée
des ganglions sentinelles
N+
Total
T1 25 0 1 1
T2 23 2 5 7
T3 46 19 12 31
T4 6 5 0 5
Total 100 26 18 44
Tableau I. Pourcentage d’envahissement ganglionnaire selon la taille de la tumeur (22).
Groupe A
Technique conventionnelle
Groupe B
Repérage du ganglion sentinelle
Stade n Atteinte
ganglionnaire (%) nAtteinte
ganglionnaire (%) p
T1 53 9,4 39 5 < 0,01
T2 85 28,2 61 13 < 0,01
T3 255 63,5 248 39 < 0,001
T4 25 64 20 40 < 0,001
Total 418* 49,5 368 34,7 < 0,001
* Soixante et onze patients classés Tis et T0 ont été exclus, de même que 11 patients en échec de la technique
du ganglion sentinelle.
▸▸▸ / ▸▸▸

320 | La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008
Ganglion sentinelle et cancer colorectal
MISE AU POINT
rapportés initialement (12, 22). Une étude pros-
pective réalisée par J.J. Joosten et al. en 1999 tend
également à limiter la place du ganglion sentinelle
dans la prise en charge des cancers colorectaux. Sur
une population de 50 patients, tous les ganglions du
curage faisaient l’objet d’un examen anatomopatho-
logique standard (coloration hémalun-éosine [HE]),
et une étude immunohistochimique était réalisée
pour les ganglions sentinelles négatifs. Avec un taux
d’identification des ganglions sentinelles de seule-
ment 70 %, l’analyse retrouvait un taux élevé de
faux négatifs (60 %) [24]. Dans leur étude multicen-
trique retrouvant un taux de faux négatifs de 54 %,
M. Bertagnolli et al. ne recommandaient pas l’utili-
sation en routine de la technique du ganglion senti-
nelle dans le cancer colorectal (27). Le faible taux
de détection pourrait s’expliquer par la nécessité
d’une phase d’apprentissage assez importante pour
maîtriser la technique, en particulier à cause de la
difficulté d’effectuer une injection complètement
circulaire autour de la tumeur, mais aussi dans le
cas des grandes tumeurs, qui nécessitent plus de
colorant afin de réaliser une injection péritumorale
complète. Le taux élevé de faux négatifs, généra-
lement lié aux tumeurs T3/T4, l’envahissement
ganglionnaire massif, la technique d’identification,
la méthodologie de l’examen anatomopathologique
et le nombre de ganglions sentinelles évalués (28),
posent également un certain nombre de questions
quant à l’apport de cette approche.
Par ailleurs, la réalisation de la technique du ganglion
sentinelle dans les localisations rectales sous-péri-
tonéales serait moins fiable que dans le cas des
cancers coliques (29, 30). En effet, l’injection du
colorant bleu est techniquement difficile en raison
de la situation anatomique profonde dans le pelvis
du rectum. Une vision claire du site d’injection n’est
pas toujours possible, l’injection manuelle du colo-
rant dans le tissu gras périmusculaire reste gênante
et l’observation en temps réel du transit du bleu
est pratiquement impossible (31). Dans leur étude
portant uniquement sur des patients atteints d’un
cancer rectal, A. Bembenek et al. rapportent un taux
de faux négatifs de 56 %. Ce taux très élevé pourrait
être lié au pourcentage important de tumeurs loca-
lement avancées (90 %) ayant reçu une radiochimio-
thérapie néo-adjuvante (86 %) [30]. Actuellement,
pour contourner ces limites, certains auteurs propo-
sent l’injection du colorant ex vivo (13), ou encore
l’utilisation en préopératoire, à travers l’endoscopie,
d’un radiotraceur (32) ayant un temps de transit
plus long et ne nécessitant pas une observation en
temps réel. Le choix des indications comportant les
tumeurs rectales localisées et n’ayant pas reçu de
thérapeutiques néo-adjuvantes semble également
important.
Intérêt de la détection des micrométastases ? ◆
Afin de déterminer la pertinence de l’utilisation de
la technique du ganglion sentinelle dans la chirurgie
des cancers colorectaux, il est important de savoir
si la présence de micrométastases a la même valeur
pronostique qu’un envahissement ganglionnaire
détecté par les techniques conventionnelles.
R. Cutait et al. ont réexaminé, par immunohisto-
chimie avec des anticorps anti-CK et anti-ACE, des
ganglions considérés N0 prélevés chez 46 patients
opérés pour un cancer colorectal non métasta-
tique. Ils ont alors retrouvé des micrométastases
chez 12 patients (26 %) [33]. De même, M.D. Jeffers
et al. ont détecté rétrospectivement par immuno-
histochimie (anti-CK) des micrométastases chez
25 % des patients d’une série de 77 patients atteints
de cancer colorectal initialement considérés N0 (34).
Tableau III. Taux de détection et de faux négatifs dans les principales études récentes.
Auteur Nombre
de patients
Taux
de détection
Méthode d’analyse
du ganglion sentinelle
Taux de faux
négatifs (%)
Métastase retrouvée uniquement
dans le ganglion sentinelle (%)
Joosten (1999)
[24]
50 35/50 (70 %) IHC 60 n.c.
Paramo (2002)
[5]
55 45/55 (82 %) Sections multiples et IHC 3 16
Bilchik (2002)
[12]
100 97/100 (97 %) IHC et PCR 5 19
Turner (2003)
[17]
51 51/51 (100 %) IHC 13 19,6
Dan (2004)
[25]
120 119/120 (99 %) Sections multiples à 20-40 µm et IHC 4,2 n.c.
Bell (2005)
[26]
58 56/58 (96,5 %) Sections multiples et IHC 16 6,9
Saha (2006)
[22]
500 489/500 (97,8 %) Sections multiples à 20-30 µm et IHC 10,1 41,1
Stojadinovic (2007)
[23]
84 82/84 (97,6 %) Sections multiples à 40 µm et IHC 9,8 10,7
IHC : immunohistochimie, PCR :
Polymerase Chain Reaction
, n.c. : non communiqué.
 6
6
 7
7
1
/
7
100%