UE : Immunopathologie et immunointervention – Physiologie

UE : Immunopathologie et immunointervention – Physiologie
Date : 18/10/11 Plage horaire : 18h - 20h
Promo : PCEM2 Enseignant : Pr JF Moreau
Ronéistes :
Moreau Charlotte [email protected]
Basset Guillaume [email protected]
Lymphocytes T et TCR
I. Introduction
II. Le récepteur T pour l'Ag ou TCR (T cell receptor)
1. Variabilité du TCR
2. Structure du TCR
3. Diversité du TCR et reconnaissance
a. Diversité combinatoire
b. Diversité jonctionnelle
III.L'activation et la transduction du LT
IV. La reconnaissance
1. Co récepteur CD4
2. Co récepteur CD8
V. Signal et molécule de Co-stimulation
1. Importance signal 2 et sa subtilité
2. Molécule de co-stimulation
3. Origine et régulation du signal 2, lien entre immunité acquise et innée
4. La synapse immunologique
VI. Conséquence de la stimulation
1. expression molécule d'activation
2. fonction cytotoxique
3. circulation et adressage des lymphocytes T
ð Rappel du site de l’assim (enseignants d’immunologie) : http://www.assim.refer.org/raisil/raisil/L02.html
ð L’immunologie ne s’apprend pas mais se comprend.
www.cdbx.org/site/spip.php?page=roneop2 1/15

I- Introduction
Le LT est le cœur du système immunitaire, c’est le cerveau liquide de toute l’entreprise.
L’immunité est le garant de la vie à la surface de la planète. Toutes les espèces qui vivent à la surface de la
planète le font grâce à leur système immunitaire. Il y a un gène sur cinq (20% du génome) qui participe à
l’immunité : c’est considérable. L’immunité est le grand marionnettiste : on ne le voit pas mais c’est lui qui
fait se mouvoir la marionnette toute entière donc qui dirige la vie.
Le LT est une cellule qui exprime à sa surface un récepteur pour l’Ag que l’on appelle le TCR. C’est le TCR qui
est important ! Le lymphocyte n’est que la manifestation physique de ce TCR moléculaire. La variabilité des
TCR (800 millions par individus) constitue son répertoire : c’est ça qui lui permet de regarder tout
l’ensemble des Ag sous forme de peptides qui sont présentés, qui sont enchâssés dans les molécules HLA
de présentation (ce ne sont pas les seules mais les plus importantes).
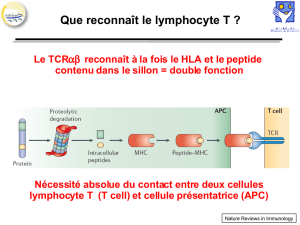
Que reconnait le TCR ?
On voit ci-contre le LT avec sa paroi, son TCR qui
interagit à la fois avec le peptide antigénique et
la molécule HLA (molécule de présentation).
Notion fondamentale : il est toujours très
pénible de voir que des gens ne savent toujours
pas que ce LT est totalement incapable de
reconnaitre les Ag de façon native.
Il circule dans le sang (2% des cellules de l’immunité). Dans le sang, il ne se passe rien du tout car il y a 1000
fois plus de GR que de GB et il y a 1000 fois moins de cellules présentatrices d’Ag (CPA) que de lymphocytes
donc il y a 1 million de fois moins de CPA que de cellules circulantes dans le sang en temps normal donc la
chance qu’a un lymphocyte d’aller reconnaître un Ag parce qu’il est présenté à la surface d’une CPA est
virtuellement nulle : c’est le rôle d’organes lymphoïdes particuliers (organes lymphoïdes secondaires) dans
lesquels circulent des LT constamment, là, il y a des CPA qui une fois qu’elles se sont trouvés un Ag dans les
tissus, vont se mobiliser et vont rejoindre ces aires secondaires : c’est là qu’il y aura présentation. Dans le
sang il ne se passe rien !!
II- Le récepteur T pour l’Ag ou TCR (T cell receptor)
Comment le LT reconnait-il l’Ag ?
On voit ci-contre une molécule de classe I avec la β2-
microglobuline, la membrane de la CPA et le TCR.
Le TCR est formé de 2 protéines : chaine α et chaine β. Il
existe 2 types de TCR : α β et γ Δ (on ne parlera que du
TCR α β qui est présent à la surface de la majorité des
LT).
www.cdbx.org/site/spip.php?page=roneop2 2/15

Ce TCR a pour vocation à s’accoupler avec la molécule de présentation. Il a une dualité fonctionnelle car il
doit reconnaitre du soi (CMH I ou II) et ce qu’il y a dedans qui n’est pas forcément du soi.
Ici, on voit les molécules HLA, le peptide logé à l’intérieur, la β2-microglobuline. Il s’agit d’un HLA de classe I,
vous voyez ici le domaine α3, les 2 domaines α1 et α2. La chaine α est en violet, la chaine β est en vert qui
vont contacter sous forme de 3 boucles d’acides aminés à la fois les HLA et le peptide.
1- Variabilité du TCR
Cette molécule il y en a toute une variété différente dans un organisme : c’est ce que l’on appelle le
répertoire. Il y en a environ 800 millions différentes à l’intérieur d’un même individu. C’est une situation
très particulière en immunologie qu’un individu puisse héberger 800 millions de versions différentes d’une
même molécule. C’est propre aux récepteurs BCR et TCR : seuls dans l’organisme ces 2 types de molécules
ont une variabilité de cet enjeu-là.
Tout l’enjeu maintenant, c’est qu’il va devoir falloir expliquer comment avec un génome assez restreint à
générer cette variabilité, qui est nécessaire à la survie des espèces (la variabilité du répertoire doit être la
plus vaste possible).
Si vous avez des restes d’analyse combinatoire, on a dit que dans les classes I il y a 9 acides aminés : 9
acides aminés avec 20 acides aminés par position, l’analyse combinatoire montre que ça fait une centaine
de milliards de peptides différents et qui peuvent se loger. Dans la mesure où on a 800 millions de TCR, il y
a des trous. Le plus important c’est qu’apparemment, un individu avec son répertoire ne peut pas tout
reconnaitre. Pour spécifique qu’il soit, le TCR n’est pas si spécifique que ça puisqu’un TCR donné peut
reconnaitre environ 500 000 peptides différents .
Si on compare 500 000 peptides aux 100 milliards, il y a bien une spécificité, mais elle n’est pas absolue. Et
c’est très bien ainsi !! Sauf pour les greffés de la moelle, les atteints du VIH ont souvent payé de leur vie le
fait d’avoir des trous dans leur répertoire.
Mais le fait que le TCR n’est pas très spécifique n’est pas un problème : on peut imaginer qu’à un TCR
correspond un peptide, on aurait alors une spécificité absolue mais alors à ce moment-là, les bêtes dont
sont issues les peptides n’auraient qu’à muter leurs peptides pour tromper les TCR. C’est là la force du
système : un TCR reconnait 500 000 peptides mais un peptide est reconnu par une foule de TCR différents
donc il y a une solidité extrême de ce système qui fait qu’il est complètement indéboulonnable (il a environ
500 millions d’années).
2- Structure du TCR
Le TCR au niveau protéique est une molécule
qui a :
- Une portion intra cellulaire
- Une portion transmembranaire d’acides
aminés (une quarantaine environ) hydrophobes
- Une portion extra cellulaire dans laquelle nous distinguons 2 domaines
o Un segment constant commun à tout un tas de TCR différents
o Un segment variable qui porte la variabilité des TCR entre eux
www.cdbx.org/site/spip.php?page=roneop2 3/15

Interaction TCR-αβ : HLA + peptide
Vous reconnaissez ici la molécule HLA, un
peptide issu d’une protéine virale, on voit
aussi une tyrosine avec son noyau
aromatique qui pointe vers l’extérieur ainsi
que le TCR.
Vous voyez qu’il y a 3 boucles essentielles
qui vont participer à ce bazar-là : 3 boucles
d’acides aminés dans la chaine αet 3
boucles d’acides aminés dans la chaine β.
Ces boucles sont rigoureusement
symétriques par rapport à un axe qui
traverse le sillon du HLA.
Le TCR se positionne sur le HLA avec un
angle de 30° par rapport à l’axe du sillon et
il va ainsi scanner le sillon. Ces boucles sont
les complementary determining region ou
CDR : il y a 3 CDR α et 3 CDR β.
Il y a un CDR1, un CDR2 et un CDR3. Les 2 CDR1 sont externes, les 2 CDR2 sont au milieu et les 2 CDR3 sont
au contact du sillon alors que les CDR1 et CDR2 sont au contact des bords du sillon donc des hélices alpha
des HLA.
La dualité fonctionnelle de cette molécule est partagée entre 2 types de domaine :
- Les domaines CDR3 qui sont responsables de regarder et de contacter le peptide qui est à l’intérieur
- Les domaines CDR1 et CDR2 qui regardent et contactent les bords du sillon
3- Diversité du TCR et reconnaissance
La portion constante ne participe pas à la reconnaissance du
HLA : cela est dévolu à la portion variable.
La portion variable est codée en CDR1, 2 et 3. Cette portion
variable est le fruit de l’union de 2 gènes : un gène V (variable)
et un gène J (jonction) : c’est ça qui va donner la variabilité de
cette jonction.
a. Diversité combinatoire :
code pour la CDR1 et la CDR2
Il existe chez l’homme un certain nombre de gènes V (cinquantaine pour la chaine β) et un certain nombre
de gènes J (environ 25).
Quand on fabrique des LT dans le thymus (seul organe qui fabrique les LT), on va fabriquer des TCR dans les
cellules qui vont devenir des LT. Ça se résume à choisir un gène V parmi la cinquantaine qui existe, le mettre
à côté d’un gène J parmi les 25 qui existent et ainsi créer une région variable qui peut être traduite en ARN.
Ce processus est appelé recombinaison ou réarrangement de ce gène est un processus très particulier
puisqu’il se passe au niveau de l’ADN. C’est très important.
www.cdbx.org/site/spip.php?page=roneop2 4/15

Quand on fabrique un LT, il va tripatouiller dans son ADN.
/!\ Il n’y a que 2 cellules dans l’organisme qui tripatouillent dans leur ADN : les LB et les LT.
En effet pour mettre à coté ces 2 gènes il faut enlever tout ce qui entre les 2 : c’est une délétion du
génome ! C’est une situation tout à fait exceptionnelle spécifique des LT ou des LB puisque les mécanismes
de réarrangement qui utilisent les enzymes RAG1 et RAG2 sont toujours les mêmes que ce soit pour les LT
ou les LB (NB : si déficit en RAG1 et RAG2 pas de recombinaison possible donc déficit immunitaire).
Il y a donc choix d’un gène V, choix d’un gène J et de cette loterie de choix provient cette diversité
combinatoire (assez limitée, de l’ordre de 1 million de molécules différentes).
Il existe une seconde diversité, la diversité jonctionnelle qui résulte d’un mécanisme très particulier.
b. Diversité jonctionnelle : code pour la CDR3
Elle n’intéresse que la jonction entre le réarrangement VJ. Au moment où la rail1 et la rail2 vont unir le bon
V et le bon J et vont couper dans l’ADN la boucle oméga qui s’est formée (cercle d’excision), il y a un
moment où le génome est coupé entre les gènes V et J.
A ce moment-là, il y a des nucléotidases qui vont bouffer les extrémités de cet ADN. Dans ce pougnac
protéique, il y a une transférase qui va rajouter au hasard des nucléotides, de façon totalement aléatoire.
Il y a donc une jonction qui sera le fruit d’une activité enzymatique aveugle. La traduction des protéines
s’opère par codons (3 nucléotides). Ce jeu du hasard est ici particulièrement délétère car 2 fois sur 3 vous
aller initier un décalage du cadre de lecture et le plus probable c’est qu’il n’y aura pas de protéine. C’est
exactement ce qui se passe. Le LT est une cellule très difficile à fabriquer (1 mois de fabrication) et 90% des
essais de fabrication sont voués à l’échec. Le résultat d’un LT est le fruit du succès de tous ces mécanismes-
là.
Lorsqu’un réarrangement n’a pas été fructueux, on n’arrive pas à fabriquer de protéines. A ce moment-là, le
LT a le choix de prendre un nouveau gène J et un nouveau gène V et à recommencer jusqu’à ce qu’il y
arrive. Il peut même aller sur d’autres chromosomes (puisqu’ils vont par paires) pour trouver le bon
réarrangement. On va d’abord essayer sur le chromosome 7 et le chromosome 14.
On va donc créer une jonction qui est très très variable : cette jonction variable scanne les peptides. Il faut
donc bien comprendre les 2 types de diversité car dans la fonction de la molécule ce n’est pas du tout la
même chose. Ça ne sert à rien de faire des CDR3 qui reconnaissant les peptides si avec les CDR1 et CDR2 on
n’est pas capables de se positionner sur nos HLA. C’est tout le rôle de l’éducation du LT.
On conserve parmi tous les LT qu’on a fabriqués que ceux qui sont capables de s’associer à nos HLA (codées
sur le chromosome 6) et que les LT qui ne sont pas capables de s’activer par rapport aux peptides qui sont
dans les poches HLA : c’est ce qu’on appelle la sélection positive qui ne garde que les TCR qui peuvent se
fixer sur les HLA. Parmi ce premier tri dans les TCR qu’on a fabriqué, on élimine ceux qui ont des capacités
d’auto-réaction : c’est la sélection négative.
NB : Les HLA, il n’en existe pas de vides à la surface des cellules : il y a toujours un peptide dedans (peptide du soi).
Il faut bien savoir que cela a pris 30 ans d’immunologie pour découvrir ça (prix Nobel en 1980 pour Jean
Dausset) : le dogme c’était que les cellules somatiques comme les LT et LB ne tripatouillaient pas dans leur
ADN, il a donc fallu beaucoup de temps pour que son idée soit acceptée. Le LT est donc un joyau de
l’évolution.
www.cdbx.org/site/spip.php?page=roneop2 5/15
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%