Données probantes et intérêt de santé publique des nouveaux antipsychotiques

L’Encéphale, 2006 ;
32 :
861-5, cahier 3
S 861
Données probantes et intérêt de santé publique
des nouveaux antipsychotiques
R. LAUNOIS
(1)
(1) Économiste, Université Paris XIII.
Il est important d’évaluer, dans l’appréciation des médi-
caments, le niveau de (la) preuve dans l’évaluation éco-
nomique, et son impact en matière de santé publique.
L’évaluation correspond à un impératif éthique vis-à-vis
du patient ; elle revêt également une fonction collective qui
doit être assumée : il est nécessaire de quantifier l’impact
de toute décision politique.
L’évaluation médico-économique consiste surtout en
l’évaluation des bénéfices apportés au malade en contre-
partie des sommes investies.
Le bénéfice clinique est représenté par l’efficacité thé-
rapeutique réelle, et la capacité du produit à contrôler la
maladie.
Le bénéfice humain est représenté par les bénéfices
de vie apportés par les médicaments : réduction du han-
dicap social, amélioration de la qualité de vie des patients,
accroissement de la satisfaction des bénéficiaires de la
prise en charge.
Enfin, le bénéfice financier est évalué par la réduction
du fardeau et des coûts de la maladie pour les familles et
pour la société.
LES TECHNIQUES D’ÉVALUATION
MÉDICO-ÉCONOMIQUE DES SOINS
AUX PATIENTS SOUFFRANT DE SCHIZOPHRÉNIE
Les techniques d’évaluation sont nombreuses. Il faut
tout d’abord former les évaluateurs et les cliniciens à
l’apprentissage à la lecture critique, base de l’EBM
(Evi-
dence Based Medicine)
. La recherche documentaire doit
être systématique, donc protocolisée : il s’agit d’une revue
quantitative (méta-analyses), qualitative, et narrative. Il
faut examiner les recommandations de pratiques clini-
ques (RPC), puis procéder à l’évaluation économique des
actes, des dispositifs et des technologies de santé (
Health
Technology Assessment
: HTA). L’Évaluation des Prati-
ques Professionnelles (EPP) et la certification des établis-
sements et des Réseaux doit parfaire le processus.
Ces diverses évaluations sont réalisées par des orga-
nismes « balkanisés », et non par un système de mono-
pole bilatéral entre la Sécurité sociale et les « producteurs
de soins ». Aujourd’hui, on retrouve trois acheteurs dans
le système de santé : l’Assurance-maladie, qui passe con-
vention avec les professionnels libéraux, l’ARH qui négo-
cie avec les acteurs hospitaliers (publics, privés à but non
lucratif, privés à but lucratif), enfin le CEPS.
Les consommateurs de soins sont représentés par les
patients et les familles, les producteurs de soins par les
hôpitaux, les médecins libéraux et les industriels, et la col-
lectivité par la HAS, la DGS et le Ministre de la Santé. Or
ces diverses entités éprouvent de grandes difficultés à tra-
vailler entre elles de façon cohérente.
LA TRIPLE EXPERTISE DU SYSTÈME D’ÉVALUATION
Le système d’évaluation comporte une expertise médi-
cale, une expertise administrative et une expertise éco-
nomique.
L’expertise médicale nécessite de définir la population
cible et les enjeux de santé publique ; elle permet de clas-
ser, selon des critères d’incidence et de gravité, le service
médical rendu et la « quantité d’effet » associée à
l’innovation ; par ailleurs, l’intérêt de santé publique (ISP)
est également défini, reposant sur la qualité de vie, l’orga-
nisation des soins, la modification des pratiques.
Les autorités administratives sont contraintes par les
limitations de leurs domaines de compétence : ainsi, la
DGS ne peut faire aucune analyse coût-efficacité ; le
CEPS ne doit raisonner qu’en termes d’impact budgétaire
du prix du médicament, sans tenir compte des répercus-
sions que pourrait avoir l’utilisation d’un médicament sur
les dépenses de soins ambulatoires ou hospitaliers ; et de

R. Launois L’Encéphale, 2006 ;
32 :
861-5, cahier 3
S 862
plus les trois premiers niveaux d’ASMR sont régis par des
prix européens.
L’expertise d’économie sanitaire a pour objet d’optimi-
ser la répartition des moyens entre les traitements et entre
les spécialités, à la recherche du meilleur retour sur inves-
tissement en termes cliniques, humains et financiers. Le
classement des projets et des innovations se fait en fonc-
tion de leur utilité sociale relative, et est ensuite confronté
à son acceptabilité par les divers acteurs et par la popu-
lation.
LA MÉDECINE FONDÉE SUR LES PREUVES :
QUELLES PREUVES ?
Les lois de la preuve médicale sont complexes. Face
à une question posée, une recherche systématique des
articles scientifiques pertinents est effectuée, prenant en
compte l’état actuel des connaissances médicales ; ces
articles sont classés en fonction de la qualité de leur
schéma d’étude ou en fonction de la qualité de leur ana-
lyse statistique. Néanmoins aujourd’hui, la hiérarchie des
niveaux de preuve est relativement dogmatique : les étu-
des randomisées sont classées en tête, puis les études
observationnelles, et enfin les séries d’observation. Cette
hiérarchie doit être remise en question.
Face au faisceau de preuves disponibles, il faut ensuite
s’interroger sur la quantité d’effet, la convergence des
résultats obtenus, et la pertinence clinique des données
probantes.
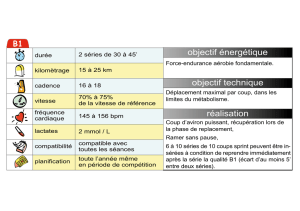
L’ANAES classe les niveaux de preuve en trois grades :
les recommandations de grade A lorsque la preuve est
scientifiquement établie ; de grade B lorsqu’il existe une
présomption scientifique, et de grade C face à un faible
niveau de preuve scientifique
(figure 1)
. Sont par exemple
classées dans les niveaux de preuve faible les études cas-
témoin, les études comparatives comportant des biais
importants, les études rétrospectives, les séries de cas,
et les études épidémiologiques descriptives, qu’elles
soient transversales ou longitudinales.
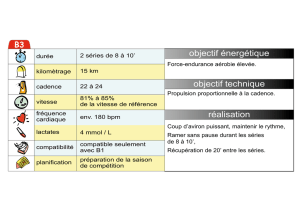
Face à des exigences importantes des autorités de
tutelle en matière de niveau de preuve, il est probable
qu’on se dirige vers une hiérarchie moins dogmatique des
protocoles d’études
(figure 2)
.
LES LIMITES DES ESSAIS RANDOMISÉS
Dans les essais randomisés, les comparaisons se font
la plupart du temps entre deux produits, et non entre toutes
les options possibles. Or le politique souhaite savoir quelle
est la place d’un produit par rapport à l’ensemble de l’arse-
nal thérapeutique existant.
Les essais randomisés présentent une version tron-
quée du génie évolutif de la maladie : ce sont des essais
à court terme par rapport à la durée réelle de la maladie,
en particulier dans les psychoses schizophréniques.
FIG. 1. —
Grade des recommandations ANAES 2000.
Niveau de preuve scientifique fourni par la littérature
Niveau 1
– Essais comparatifs randomisés de forte puissance
– Méta-analyse d’essais comparatifs randomisés
– Analyse de décision basée sur des études bien menées
Niveau 2
– Essais comparatifs randomisés de faible puissance
– Études comparatives non randomisées bien menées
– Études de cohorte
Niveau 3
– Études cas-témoin
Niveau 4
– Études comparatives comportant des biais importants
– Études rétrospectives
– Séries de cas
– Études épidémiologiques descriptives (transversale,longitudinale)
Grade des recommandations
A
Preuve scientifique établie
B
Présomption scientifique
C
Faible niveau de preuve scientifique

L’Encéphale, 2006 ;
32 :
861-5, cahier 3 Données probantes et intérêt de santé publique des nouveaux antipsychotiques
S 863
Les essais multicentriques randomisés nient les réali-
tés épidémiologiques et institutionnelles locales. Autre
limite : les essais randomisés scotomisent des éléments
décisifs pour la prise de décision politique, comme les évé-
nements indésirables, la qualité de vie, la trajectoire du
patient dans le système de soin et ses contacts avec les
professionnels de santé, les tarifs comparatifs des diffé-
rents modes de prise en charge, et toutes les informations
autres que celles se rapportant à la taille de l’effet.
Les modèles expérimentaux apparaissent trop éloi-
gnés de la pratique courante : ils sont trop centrés sur la
maladie, en négligeant le malade ; ils sont trop restrictifs
dans leurs critères d’inclusion, dans leurs critères de juge-
ments, temporellement limités dans leur suivi, excessive-
ment rigoristes dans leurs protocoles de surveillance, et
trop homogènes dans les populations étudiées.
LES ENQUÊTES OBSERVATIONNELLES
Parallèlement aux études randomisées, des études
observationnelles à visée exclusivement descriptives se
préoccupent plus de l’usager de soins (« malade » ou
« client »), en se penchant sur les effets des comporte-
ments sur l’efficacité, en particulier les comportements
d’observance thérapeutique par rapport aux effets
indésirables ; sur les plaintes psychosociales liées à la
maladie, en s’appuyant par exemple sur des échelles de
qualité de vie ; ou encore en se penchant sur les réper-
cussions des traitements sur les trajectoires de soins ou
les contacts avec les soignants.
Ces enquêtes observationnelles se déroulent sans
comparateur : une enquête est dite observationnelle lors-
que tout se serait passé de la même façon s’il n’y avait
pas eu d’étude. Ces études observationnelles partent des
réalités de terrain pour les décrire de la manière la plus
fidèle possible, mais l’absence de plan expérimental aug-
mente les risques de biais et rend plus difficile l’analyse
de causalité.
LA DÉMARCHE QUALITÉ
EN SITUATION NORMALE D’USAGE
Le dilemme de l’évaluateur est donc de chercher un
moyen de combler l’écart entre la prise en charge réelle
et l’expérimentation, en particulier par des études post-
AMM. Il faut donc rechercher l’efficacité populationnelle
des traitements : aujourd’hui la prise en charge globale
des malades repose sur la création de recueils d’informa-
tions cliniques, humaines, économiques et sociales en
santé, dans le cadre de la pratique médicale quotidienne.
FIG. 2. —
Vers une hiérarchie des protocoles d’études moins dogmatique ?
Coupe
transversale
Étude
Avant-Après
OUI
OUI
NON
NON
NON
NON
une Seule
plusieurs
Étude
cas-contrôle
les événements ±
NON
OUI
les risques ±
Prospective ? NON
OUI
NON
OUI
OUI
OUI
Individus
Centres
Absence
de preuve
Adéquation
Faible
de la preuve
Comparaison
exposée/non exposée ?
(1)
Au même
moment et sur le même
Groupe ?
Étude descriptive – Étude normative
Séries d’observations
(2)
A des moments
différents et sur le même
Groupe ?
(3)
A des moments
différents sur deux groupes
et Attribution
controlée ?
Combien
de mesures
Avant-Après ?
Quels
paramètres
définissent les
groupes ?
Schéma d’étude
de cohorte avec critères
d’inclusion ?
Séries Temporelles
Interrompues
Schémas AA ou STI
avec groupe contrôle
Cohorte rétrospective
avec contrôle interne
Essai comparatif
non randomisé
Randomisation
par patient
Randomisation
par établissement
(4)
Attribution aléatoire
au risque ?
(5)
Niveau de
randomisation
Adéquation
Modérée
de la preuve
Adéquation
Forte de
la preuve
Cohorte prospective
avec contrôle interne

R. Launois L’Encéphale, 2006 ;
32 :
861-5, cahier 3
S 864
La démarche de l’évaluateur chargé de l’analyse des
données est de s’interroger sur les différents axes de
qualité : qualité des plans expérimentaux, qualité du
recueil des informations, qualité des pratiques médicales
par rapport à des référentiels définis, qualité de vie des
patients, et qualité de la formation des patients.
Des études se sont par exemple intéressées, sur des
cohortes de patients schizophrènes, d’une part à la domi-
ciliation des patients : en hôpital, en domicile privatif, ou
en résidence collective (appartements protégés, maisons
de retraites…) ; d’autre part à l’intensité des soins, à l’aide
d’un indicateur de poids de prise en charge, en fonction
du nombre de jours d’hospitalisation complète, d’hospita-
lisation de jour, d’hospitalisation de nuit, et du nombre
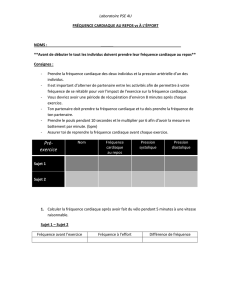
d’actes ambulatoires. Ces deux séries de données per-
mettent la construction d’un algorithme de décision, per-
mettant de classer durant 3 ans de suivi les patients sui-
vant la filière suivie au cours de la prise en charge
(figure 3)
. La prise en charge des patients pouvait ainsi
être classée en prise en charge intensive et prise en
charge courante, par des coupes transversales des cohor-
tes réalisées tous les 6
mois.
Il est ainsi possible d’objectiver des différences de prise
en charge selon les sites étudiés, par exemple en terme
de retour des patients à l’hôpital, ou du développement
de la prise en charge ambulatoire.
L’évaluation de l’éducation thérapeutique est égale-
ment très importante. Le terme d’éducation thérapeutique
reflète un changement profond dans les modalités de prise
en charge : l’alliance thérapeutique, où le malade est un
partenaire, est à distinguer du colloque singulier, où le
malade, dans une relation très asymétrique, renonce à
défendre ses propres intérêts en demandant au médecin
de le faire à sa place ; on passe d’une logique d’ensei-
gnement à une logique d’apprentissage, où se dévelop-
pent les capacités d’auto-prise en charge du patient et son
implication personnelle, puisqu’il a le sentiment qu’il peut
agir sur sa santé et sur sa vie.
APPROCHE MÉDICO-ÉCONOMIQUE
Les données cliniques et les paramètres économiques
doivent désormais s’apprécier de façon conjointe : il n’est
plus possible d’évaluer une pratique clinique sans prendre
en compte son versant financier. Il est nécessaire de pri-
vilégier la mise en œuvre du traitement qui offre les
meilleurs bénéfices thérapeutiques pour une somme glo-
bale allouée.
Les données cliniques sont des données individuelles,
sujettes à des fluctuations aléatoires ; à partir du tableau
clinique, l’évaluation des pratiques médicales et du suivi
thérapeutique permet une quantification du résultat (en
terme de survie, de récidive, et d’effets indésirables) et du
bénéfice thérapeutique.
Les données qui doivent être recueillies sur le plan
administratif concernant le coût des soins sont les dépen-
ses de soins ambulatoires reconnues et remboursées par
FIG. 3. —
Algorithme de classement par filière.
oui
non
oui
oui oui
non
non non
Prise en charge
lourde à l'hôpital
Prise en charge intensive
à domicile
Prise en charge intensive
en résidence
Prise en charge courante
à domicile
Prise en charge courante
en résidence
Durée d'hospitalisation complète
> 120 jours ?
Durée d'hospitalisation complète
> 30 jours
ou indicateur de prise en charge
> 120 points ?
Prise en charge intensive
en ambulatoire
Prise en charge courante
en ambulatoire
Prise en charge à domicile ?Prise en charge à domicile ?

L’Encéphale, 2006 ;
32 :
861-5, cahier 3 Données probantes et intérêt de santé publique des nouveaux antipsychotiques
S 865
malade consommant et par an au titre des assurances
santé avant et après intervention, les dépenses de con-
sultations auprès du médecin généraliste et du spécialiste
avant et après intervention, les dépenses de prescriptions
avant et après intervention, et la structure des dépenses
de prescriptions avant et après intervention, ceci dans le
groupe témoin et dans le groupe expérimental.
Pour déterminer le montant à investir pour obtenir le
résultat attendu, il faut raisonner en terme de rapport
investissement additionnel/quantité d’effet induit, ou rap-
port coût/efficacité. Lorsqu’un nouveau traitement est plus
efficace (ou mieux toléré) et plus cher, la question qui se
pose à l’économiste est de déterminer si le surcoût est jus-
tifié par l’importance du bénéfice supplémentaire obtenu.
La limite pour accepter un nouveau traitement plus cher
est ainsi du registre de la « solidarité des bien-portants »,
qui sont prêts à payer plus (en terme de prélèvements obli-
gatoires et de cotisations sociales) seulement si le « retour
sur investissement » est suffisamment important.
COMMENT ÉCLAIRER LA DÉCISION POLITIQUE ?
L’évaluation du rapport bénéfice/coût apporté par un
nouveau traitement peut également s’exprimer en terme
de gain net de santé publique, positif ou négatif, apporté
par un nouveau traitement. L’évaluation de « l’intérêt de
santé publique » conduit à choisir un nouveau traitement
par rapport à l’ancien lorsque le gain net de santé publique
est positif, pour une valeur donnée du risque financier
socialement acceptable.
Pour éclairer la décision politique, il est nécessaire de
rassembler tous les éléments qui participent à la prise de
décision : efficacité thérapeutique, préférences du patient,
qualité de vie, efficacité économique ; puis effectuer une
synthèse généralisée des données probantes en utilisant
les essais cliniques randomisés, les essais comparatifs,
les études de cohorte, les études miroir, la pratique clini-
que, les avis d’experts…
Cette synthèse de l’information peut être effectuée par
des outils spécifiques, fournissant des méta-analyses
décisionnelles permettant de comparer les investisse-
ments et l’utilité pour la collectivité. Ces méta-analyses
décisionnelles permettent de structurer l’information dans
un cadre de référence unique, de considérer simultané-
ment les bénéfices, les risques et les coûts, d’estimer, non
plus de manière intuitive, mais quantitativement la fré-
quence de survenue des événements évolutifs, et de
reconstituer les trajectoires de prise en charge et de chaî-
ner les coûts.
CONCLUSION
L’apparition de bases de données alimentées par les
professionnels bouleverse les méthodes d’évaluation. De
nouveaux protocoles d’étude sont mis en œuvre, des cri-
tères de jugements nouveaux apparaissent, portants par
exemple sur l’évaluation de la qualité de vie, ou l’estima-
tion du surcroît d’investissement requis pour obtenir le ser-
vice attendu.
Globalement, une perspective nouvelle apparaît par
rapport aux devoirs des médecins et des soignants : com-
ment prodiguer des soins et fournir le meilleur service pos-
sible, mais ceci en rapport avec l’argent investi.
1
/
5
100%