Dossier Rhizo ok 10-01/6

LES DOSSIERS KWS
RHIZOMANIE
La rhizomanie
avance…
La recherche
KWS
la devance
couverture 14/10/05 19:03 Page 1

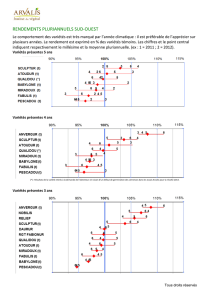
2
RHIZOMANIE
Dossier Rhizo ok 10-01/6 14/10/05 18:33 Page 2

3
Direction technique ITB
Marc Richard-Molard
Institut de Biologie Moléculaire des Plantes
Gérard Jonard
Responsable Service Agronomique Cristal Union
Philippe Clouet
Responsable Service Agronomique SDHF
Jean-Marie Vion
Producteur betteravier de Seine-et-Marne
Patrick Chaussy
Sélectionneur du groupe KWS AG
Andréas Loock
Responsable du Centre de Sélection et d’Expérimentation KWS France
Olivier Cugnet
L’Institut National de Recherche Agronomique
L’Institut des Plantes
Groupe d'Étude et de Contrôle des Variétés et des Semences
Journal de l’Économie - Mensuel de l’économie alsacienne
Le Betteravier Français
Le Groupe Réussir
Le Centre National de Recherche Scientifique
Diffchamb France SARL
Direction Régionale de l’Agriculture et de la Forêt - Bretagne
Nous tenons à adresser nos remerciements
pour leur collaboration et l’aide qu’ils nous ont apportée à :
Remerciements
Dossier Rhizo ok 10-01/6 14/10/05 18:33 Page 3

L
e monde et la science ont leurs données
propres, qui se touchent et ne se pénètrent
pas. L’une nous montre à quel but nous
devons viser, l’autre, le but étant donné,
nous donne les moyens de l’atteindre.
Henri Poincaré
Mathématicien français
Sur la Terre, tout a une fonction ;
chaque maladie une herbe pour la guérir,
chaque personne une mission.
Sagesse indienne
4
Dossier Rhizo ok 10-01/6 14/10/05 18:34 Page 4

5
Préface
Andréas Loock
Sélectionneur du Groupe KWS AG
La rhizomanie est une des maladies les plus importantes qui touche la betterave à sucre en
Europe. Depuis sa première apparition en Italie, cette maladie s'est largement répandue. On peut
aujourd'hui la déceler dans presque tous les pays d'Europe, de manière à constituer une réelle
menace pour la culture betteravière. Les pertes de rendement pour les variétés susceptibles d'être
touchées peuvent aller jusqu'à 80 %. La teneur en sucre peut être réduite jusqu'à 60 %. La
production de betteraves à sucre dans ces régions perdrait toute rentabilité.
La rhizomanie, que l'on nomme également virus des nervures jaunes et nécrotiques de la betterave
est une maladie virale qui touche l'appareil foliaire et plus particulièrement les parties racinaires
des betteraves. Selon la nature du sol, on distingue différents types de virus - A, B, P. La rhizomanie
se transmet par un champignon du sol qui héberge le virus, appelé
Polymyxa betae
.
Une lutte curative contre la rhizomanie, par le biais de mesures préventives de protection des
plantes (notamment au niveau de l'hygiène du terrain et des techniques culturales), s'est révélée
sans succès les années précédentes. Seule une culture moderne, basée sur la tolérance de la
betterave, offre une solution de lutte contre cette maladie et rend possible une culture betteravière
étendue dans les régions les plus concernées par la rhizomanie.
Les premières variétés tolérantes à la rhizomanie ont fait leur apparition en 1983. Les performances
de ces variétés étaient évaluées en terrain sain. La richesse et la tolérance de la plante étaient très
limitées. Les années suivantes, le rendement et la qualité ont nettement pu être améliorés grâce à
un travail intensif de sélection. Au sein du programme génétique classique, le rendement sucre
blanc profite d’un progrès génétique de 1 à 1,5 % par an. Simultanément, un programme de
recroisement a permis de réduire nettement l’écart de rendement entre le matériel rhizomanie et
classique.
Si les premières variétés tolérantes révélaient un potentiel de rendement uniquement en milieu
infesté, les variétés tolérantes ont maintenant atteint le potentiel de rendement des variétés
classiques en terrain sain. A l'avenir, il y a deux challenges pour la filière betterave/sucre : il est
nécessaire de regrouper de plus en plus les différentes sources de tolérance à la rhizomanie pour
assurer, à long terme, la tolérance à la rhizomanie. Les sources de tolérance à la rhizomanie
devront être associées à d’autres types de tolérance ou de résistance, étendues à d’autres
maladies ou parasites.
Dossier Rhizo ok 10-01/6 14/10/05 18:34 Page 5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%