Norovirus - Swiss Medical Forum

Forum Med Suisse 2010;10(4):65 65
curriculum
Norovirus
Peter Graber
Infektiologie und Spitalhygiene, Kantonsspital Liestal, Liestal
Introduction
Depuis quelques années, les norovirus font les grands
titres à chaque période hivernale. Ces virus très conta-
gieux provoquent régulièrement des épidémies de gas-
tro-entérite aiguë dans de nombreux pays. Hôpitaux,
homes, écoles et autres institutions dans lesquelles les
gens vivent à l’étroit sont particulièrement touchés. Il
n’est pas rare que des services hospitaliers doivent être
fermés avec interdiction de visite et blocage des admis-
sions. A l’extrême, suite à la maladie du personnel, cela
peut en arriver àune situation d’urgence dans les soins.
Les croisières en bateau sont régulièrement touchées
par des épidémies à norovirus [1]. Si un seul cas se dé-
clare, une bonne partie des passagers et de l’équipage
en feront les frais peu après. Les bateaux sont mis en
quarantaine, les patients évacués et des mesures éner-
giques de nettoyage et de désinfection sont prises. De
telles épidémies attirent toujours une grande attention
des médias.
Historique
Le tableau clinique de l’infection à norovirus, caracté-
risé par les symptômes cardinaux diarrhée aiguë, nau-
sée et vomissement, a été décrit en détail en 1945 déjà
[2]. Appelée grippe intestinale ou «winter vomiting dis-
ease» par les Anglo-Saxons, l’étiologie de cette maladie
n’a pas pu être définie plus précisément pendant des
décennies. En 1968, dans une école de Norwalk, Ohio,
s’est déclarée une épidémie de gastroentérite. Le pa-
thogène suspecté a été appelé «Norwalk agent» [3].
C’est en 1972 que Kapikian a découvert une particule
virale de 27 nm au microscope électronique dans les
selles d’un volontaire infecté par un filtrat de selles pro-
venant de l’épidémie de Norwalk [4]. Elle a reçu le nom
de «virus de Norwalk». Un autre virus apparenté sur la
base de la description de la microscopie électronique
est le «Small Round Structured Virus», ou SRSV. Avec
les analyses morphologiques et phylogénétiques, ce vi-
rus a été rebaptisé «norovirus» il y a quelques années
par l’«International Committee on Taxonomy of Vi-
ruses». Son synonyme est «Norwalk-like virus» (NLV).
Pathogène
Le norovirus fait partie de la famille des calicivirus (Ca-
liciviridae) humains. Les analyses phylogénétiques
classent les norovirus en 5 génogroupes (GI à GV), qui
à leur tour peuvent être subdivisés en clusters ou géno-
types [5]. Les calicivirus pathogènes humains provien-
nent des génogroupes GI, GII et GIV. Les norovirus du
cluster génétique GII.4 ont été responsables de la plu-
part des épidémies de ces dernières années dans les
pays industrialisés [6].
Comme il n’existe aucun modèle animal adéquat, les
connaissances sur les norovirus pathogènes humains
sont pour la plupart basées sur des épidémies et études
chez des volontaires. Ce virus ne se multiplie en outre
pas dans les cultures cellulaires habituelles [7]. Ce n’est
que tout récemment qu’un groupe de chercheurs
américains a réussi à faire se multiplier le norovirus
dans une culture de cellules organoïde complexe, tri-
dimensionnelle de cellules épithéliales d’intestin grêle
humain [8].
Epidémiologie
L’ incidence des gastro-entérites à norovirus a été sous-
estimée par le passé car il n’y avait aucune possibilité
de les mettre en évidence à large échelle. En fait les no-
rovirus sont la cause la plus fréquente de la gastroenté-
rite virale aiguë dans le monde entier. Cela vaut aussi
bien pour les cas sporadiques que pour les flambées
Vous trouverez les questions à choix multiple concernant cet article
à la page 56 ou sur Internet sous www.smf-cme.ch.
Quintessence
PL’ infection à norovirus est la cause la plus fréquente de gastroentérite
aiguë.
PLes norovirus provoquent régulièrement des épidémies dans les hôpi-
taux et homes, surtout à la saison froide.
PLes norovirus sont éliminés par les selles et vomissements et sont très
contagieux. Quelque 100 particules virales peuvent déjà provoquer une
contamination. Un gramme de selles peut contenir env. 100 millions de
ces particules.
PLes cas suspects doivent absolument être isolés.
PLes mesures d’hygiène hospitalière comportent une bonne hygiène
des mains avec désinfectants actifs contre les virus et une prévention des
contacts avec gants, blouses et masques faciaux avant d’entrer dans la
chambre du patient.
PLa maladieest autolimitée. Le traitement est symptomatique. Des évo-
lutions plus longues et complications sont possibles chez les personnes
très âgées et les patients porteurs de graves maladies, surtout par pertes
hydroélectrolytiques.
Peter Graber
L’ auteur certifie
qu’aucun conflit
d’intérêt n’est
lié à cet article.

Forum Med Suisse 2010;10(4):66 66
curriculum
épidémiques [9]. Rien qu’en Angleterre et au Pays de
Galles 650000 cas de gastroentérite à norovirus se dé-
clarent chaque année [10]. Aux Etats-Unis, ce chiffre
est estimé à 2,3 millions. Des études ont montré que
93% de 233 épidémies de gastroentérite entre 1997 et
2000 aux Etats-Unis et 85% de 3714 épidémies entre
1995 et 2000 en Europe
étaient dues aux noro-
virus [6, 11]. En Suisse
allemande uniquement
73 épidémies ont été
recensées entre 2001 et
2003 [12].Les épidé-
mies d’infections à norovirus éclosent de préférence là
où des personnes vivent très proches les unes des
autres et le virus peut rapidement se transmettre par
les vomissements et les diarrhées. En Suisse, 34% ont
été enregistrées dans des homes pour personnes âgées
et 25% dans des hôpitaux [12].
La grande contagiosité et l’insensibilité des norovirus
aux influences extérieures sont d’importantes condi-
tions pour une dissémination efficace de ces patho-
gènes. Des études récentes confirment l’observation cli-
nique que la dose infectieuse minimale est très faible.
10% des volontaires sains sont infectés avec une dose
inoculée de 103génomes viraux, et 70% avec 108[13].
Quelque 100 millions de particules virales sont élimi-
nées dans chaque gramme de selles [14]. Dans les ins-
titutions communautaires, la transmission d’homme à
homme est de loin la plus importante voie d’infection.
La principale est la transmission fécale-orale, soit di-
rectementd’homme àhomme ou indirectement par des
surfaces ou objets contaminés [15]. Le vomissement
produit des gouttelettes qui seront transportées sur de
longues distances. Dans les cas sporadiques ou épidé-
miques hors institution, les aliments ou l’eau potable
contaminée sont une cause fréquente [16]. Dans les
pays industrialisés, la moitié de ces cas environ est
associée à des personnes malades travaillant dans le
secteur alimentaire. Huîtres et moules sont des causes
d’épidémie bien documentées dans la littérature [17,
18]. Les huîtres filtrent d’importantes quantités d’eau
avec pour conséquence une accumulation de norovirus.
Des pluies importantes avec de grandes quantités d’eau
de surface s’écoulant dans la mer peuvent être à l’ori-
gine de la contamination des ostréicultures [17]. Une
étude sur des huîtres importées en Suisse a montré la
présence de norovirus dans 8 échantillons sur 87
(9,4%) [19].
Les épidémies à norovirus ont un caractère saisonnier
très marqué, surtout pendant les mois d’hiver et au
printemps. Une explication pourrait être la relation
complexe entre environnement et hôte d’une part et
immunité focale (d’une population contre telle ou telle
souche de norovirus) de l’autre. Des températures
basses, un rayonnement ultraviolet plus faible en hiver
de même que la vie plus à l’étroit de la population pen-
dant la saison froide augmentent le potentiel de conta-
mination. Ces facteurs peuvent quant à eux déclencher
une épidémie saisonnière qui avec la contamination de
la population provoque une immunité focale avec flé-
chissement progressif de l’épidémie au printemps.
C’est à ce moment que la pression de sélection est la
plus élevée pour le virus et en été arrivent de nouvelles
variantes génotypiquement différentes [20]. Il s’est
avéré que l’augmentation des épidémies à norovirus
dans le monde entier est fonction de la dissémination
épidémique de nouvelles variantes [21].
Pathogenèse et réponse immunitaire
Nous savons depuis les années 1970 que certains fac-
teurs de l’hôte jouent un rôle dans l’infection à noro-
virus. Des études chez des sujets sains ont montré que
certains ne développeront pas d’infection.
Des études récentes montrent que les norovirus se lient
aux cellules épithéliales gastro-intestinales par des sé-
quences polysaccharidiques spécifiques d’antigènes
de groupe sanguin [22].
Les antigènes des sys-
tèmes A, B, O et Lewis
sont des récepteurs de
ce virus. Les entérocytes
matures des sommets
des villosités intestinales
expriment dans une
importante mesure ces
antigènes sanguins et servent donc de cellules cibles
préférentielles aux norovirus [23].
La protection de certaines personnes est mise en rela-
tion avec l’absence de récepteur au norovirus. Les dif-
férentes souches de norovirus utilisent cependant diffé-
rents antigènes de groupe sanguin comme récepteurs,
ce qui fait qu’aucune protection n’est garantie contre
toutes les souches.
Les norovirus se sont parfaitement adaptés à leur hôte
dans leur évolution. Leur cycle de vie est relativement
simple. Ils se répliquent dans les entérocytes, provo-
quent une maladie de brève durée et sont éliminés en
grande quantité pour infecter leur prochaine victime.
Pour se multiplier dans la cellule infectée, le virus se sert
d’une propre polymérase d’ARN qui contrairement àde
nombreuses autres polymérases n’a pas de fonction
correctrice, ce qui fait que les mutations sont fréquentes
et que la diversité antigénique est grande [24]. Il n’est
donc pas étonnant que les norovirus n’induisent pas de
réponse immunitaire importante et prolongée. Les per-
sonnes ayant contracté une infection peuvent ainsi re-
tomber malades la saison suivante.
Manifestation clinique
L’ infection à norovirus se manifeste par un épisode gé-
néralement violent et autolimité de gastroentérite chez
des personnes par ailleurs en parfaite santé (fig. 1 x).
Après une période d’incubation de 6 à 48 heures sur-
viennent nausée (95%), vomissements (81%), crampes
abdominales (83%) et diarrhée aqueuse (83%). Les
diarrhées sans vomissement ou les vomissements uni-
quement touchent un patient sur 5 environ (19 et 17%
resp.). La diarrhée sanguinolente ne se voit pratique-
ment jamais et doit faire penser à une autre étiologie.
Le vomissement produit des
gouttelettes qui seront
transportées sur de longues
distances
Lesnorovirus n’induisent
pas de réponse immunitaire
importante et prolongée
car pour se multiplier
ils se servent d’une propre
polymérase d’ARN

Forum Med Suisse 2010;10(4):67 67
curriculum
Les épisodes de gastroentérite s’accompagnent géné-
ralement de malaise, douleurs dans les membres et
fatigue. 50% env. des patients ont des températures
subfébriles. Chez la plupart des adultes par ailleurs en
bonne santé cette maladie ne dure que 2–3 jours.
Chez les patients hospitalisés, les vieillards et les en-
fants cette maladie peut évoluer plus sérieusement et
avoir des complications. Une étude d’une épidémie à
norovirus dans un hôpital universitaire allemand a
montré que 8,3% des patients ont présenté des compli-
cations. Les maladies cardiovasculaires et un status
après transplantation rénale ont été des risques signifi-
catifs d’hypokaliémie dangereuse. L’ immunosuppres-
sion a été un risque d’insuffisance rénale aiguë, et un
âge >65 ans a été significativement associé à une durée
prolongée de cette maladie [26]. Une autre étude ayant
porté sur 4378 cas apparus dans 4 centres hospitaliers,
11 hôpitaux régionaux et 135 homes a montré une
nette différence de la gravité de la maladie entre le
personnel et les patients hospitalisés [27]. La durée
médiane de la maladie a été de 2 jours pour le person-
nel des hôpitaux ou des homes, et après 3 jours
75% étaient asymptomatiques. Chez les patients hospi-
talisés, la durée médiane a été de 3 jours et ce n’est
qu’après 5 jours que 75% ont été asymptomatiques
(p <0,001). La durée de la maladie a été la plus longue
chez les patients de >85 ans, dont 40% étaient encore
symptomatiques après 4 jours. Il a en outre été dé-
montré que chez les patients dont les symptômes ont
duré 4 jours ou plus, l’excrétion virale par gramme de
selles était en moyenne 100 fois supérieure à celle de
patients dont les diarrhées ont duré 1–3 jours (10,49
contre 8,48 log10 copies/g de selles, p <0,001) [28]. L’ ex-
crétion virale maximale se fait pendant la phase symp-
tomatique. Ensuite de quoi le virus peut être présent
longtemps encore. Des études chez des personnes
âgées ont montré que le norovirus peut être présent
dans les selles pendant 28,7 jours en moyenne (13,5–
44,5 jours) [29].
Diagnostic
Une PCR existe depuis quelques années pour recher-
cher les norovirus. La Reverse-Transcriptase-PCR
montre l’ARN spécifique de ces virus. Cette méthode est
très sensible et spécifique. De nombreux laboratoires
proposent cet examen chaque jour et permettent de
confirmer rapidement le diagnostic. Mais il n’est pas
toujours indispensable de prouver la présence de ce vi-
rus par PCR. Le coût de cette méthode selon la liste des
analyses actuellement en vigueur est relativement
élevé, soit de 180 francs.
Si plusieurs cas se déclarent, le diagnostic d’infection à
norovirus peut être posé cliniquement avec les critères
de Kaplan (tab. 1 p) de manière assez fiable [30]. Mais
ces critères se basent sur la description de l’infection à
norovirus chez des personnes par ailleurs en parfaite
santé.
Le diagnostic différentiel de l’infection ànorovirus com-
porte une infection à rotavirus, surtout chez l’enfant, et
qui chez l’adulte provoque plus fréquemment des diar-
rhées et moins de vomissements. Les intoxications
alimentaires par toxines staphylococciques ont une
période d’incubation plus brève. Chez les patients
hospitalisés, les effets médicamenteux indésirables
(nausée, vomissement) et les diarrhées secondaires aux
antibiotiques ou aux laxatifs doivent entrer dans le
diagnostic différentiel. Le diagnostic de l’infection à
norovirus est ici nettement plus difficile car la sympto-
matologie n’est souvent pas classique.
Tr aitement
Il n’y a aucun traitement spécifique. Les mesures de
soutien rapides telles qu’apport hydroélectrolytique,
contrôle de la fonction rénale et éventuellement hospi-
talisation sont particulièrement importantes chez les
personnes très âgées, les patients immunosupprimés
ou multimorbides.
Hygiène hospitalière
Du fait que ce virus est très contagieux et peut atteindre
une contamination de 90%, il est très important d’en
poser rapidement le diagnostic par la clinique. Toutes
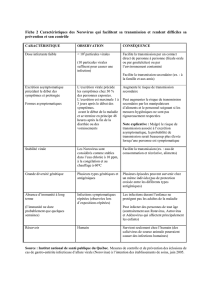
les mesures d’hygiène indispensables (tab. 2 p) doi-
vent être prises dès la moindre suspicion d’infection à
norovirus et sans attendre la confirmation par la viro-
logie [31], ce qui exige une information rapide de tout
l’hôpital sur une reprise d’activité du norovirus. L’ isole-
Ta bleau 1. Critères de Kaplan pour le diagnostic clinique
de l’infection à norovirus [30].
Vomissements (souvent en salve) dans >50% des cas
Diarrhée aqueuse aiguë
Durée de la maladie 12–60 heures
Période d’incubation 6–48 heures
Personnel et patients touchés
Figure 1
Incidence des symptômes cliniques d’une infection à norovirus. Partie orangée: diarrhée
uniquement; partie jaune: vomissement uniquement (d’après Schneider et al. [31]).

Forum Med Suisse 2010;10(4):68 68
curriculum
ment immédiat est la mesure la plus importante. Notre
expérience nous montre que jusqu’à 25% des épidé-
mies à norovirus proviennent de l’extérieur. Il s’agit
d’une part de patients hospitalisés pour déshydratation
sur gastroentérite ai-
guë. Chez les personnes
très âgées d’autre part,
les symptômes d’infec-
tion à norovirus peu-
vent ne se manifester
que sous une forme at-
ténuée et n’être diagnostiqués comme cofacteurs d’une
maladie de base décompensée qu’après une anamnèse
fouillée. Le service des urgences joue un rôle clé dans
l’évaluation rapide de tels patients et l’application des
mesures d’hygiène, ce qui exige une collaboration in-
terdisciplinairetrès étroite entre médecins, soignants et
hygiène hospitalière. Toute admission d’un patient
ayant une diarrhée aiguë et/ou des vomissements im-
plique la recherche d’une infection ànorovirus. En l’ab-
sence de toute autre explication évidente à sa sympto-
matologie, le patient est mis en isolement. Un diagnostic
des selles par PCR se limite en général aux cas sans re-
lation épidémiologique avec d’autres cas connus d’in-
fection à norovirus, ou aux patients ayant une sympto-
matologie atypique.
Le tableau 2 présente les mesures d’hygiène recom-
mandées àl’hôpital contre les norovirus [32]. Le patient
est si possible seul dans une chambre avec toilettes, ce
qui n’est souvent pas possible s’il y a de nombreux cas,
et les patients sont alors isolés en groupe ou avec leurs
voisins (encore) asymptomatiques. Il faut définir les
toilettes et salles d’eau que seuls les patients ayant une
infection à norovirus peuvent utiliser. Tous ceux qui en-
trent dans la chambre doivent porter des blouses, gants
et masques faciaux (chirurgicaux). Les patients ne doi-
vent quitter leur chambre que pour des interventions
diagnostiques ou thérapeutiques urgentes. Il est impor-
tant d’informer rapidement les services (par ex. salles
d’endoscopie, de radiologie, etc.) et de bien planifier les
examens nécessaires. Il faut éviter de déplacer les
patients souffrant de gastroentérite à l’intérieur de
l’hôpital. En cas de très grande activité des norovirus,
envisager d’interdire les visites dans les services les
plus touchés.
Les norovirus font partie des virus dits non encapsulés.
Ces derniers se caractérisent par une forte résistance
(«ténacité») aux conditions extérieures et aux désinfec-
tants. L’ activité des désinfectants pour les mains à base
d’éthanol augmente avec la teneur en alcool (>70%). Un
virus substitut est testé, le calicivirus félin. Ce sont les
produits à 95% d’éthanol qui sont les plus actifs [33].
Mais l’activité estfortement influencée par la charge or-
ganique de la suspension test. Nul ne sait exactement
quelle séquence de tests reflète le mieux les conditions
cliniques. Les désinfectants pour les mains à base de
propanol, utilisés de routine dans de nombreux hôpi-
taux, sont également actifs. Le 1-propanol est un peu
plus efficace que l’isopropanol (2-propanol) [34]. La
désinfection hygiénique des mains est plus importante
que le choix du produit. Le désinfectant doit pouvoir
agir pendant30secondes au moins. La désinfection des
mains doit se faire avant et après tout contact avec le
patientetsurtout après le retrait des gants. Les patients
et leurs visiteurs doivent eux aussi apprendre à la faire
correctement.
Les sols des services contaminés doivent être régulière-
ment désinfectés par des produits actifs contre les noro-
virus [15]. Ce peuvent être des désinfectants oxygénés,
des produits contenant
des aldéhydes ou àbase
de chlore (Javel). Dans
nos services contaminés
nous désinfectons toutes
les surfaces et tous les
sols chaque jour,les toi-
lettes deux fois par jour.Ces mesures sont poursuivies
3jours, 7jours pour les toilettes après levée de l’isole-
ment du dernier patient.
L’ isolement se poursuit 48 heures après disparition des
symptômes. Bien que le virus puisse toujours être dé-
montré dans les selles, le risque de contagion est relative-
ment faible si le patient aretrouvé le contrôle de ses exo-
nérations. Au terme de l’isolement, la chambre doit faire
l’objet d’une désinfection dite finale. Avec les sols, toutes
les surfaces de contact ycompris montants de portes,
boutons de sonnette, interrupteurs, téléphones, etc., sans
oublier les rideaux. Le lit doit également être désinfecté.
Le personnel malade doit immédiatement être mis en
congé. Certains experts recommandent un arrêt de tra-
vail jusqu’à 48 heures après la disparition des symp-
tômes [25]. Dans les services sérieusement contaminés
cela peut cependant provoquer des problèmes critiques
de soins par manque de
personnel. Le transfert
de personnel au sein
même de l’hôpital peut
favoriser la dissémina-
tion de la maladie. Dans
notre hôpital, nous au-
torisons la reprise du travail immédiatement après la
disparition des symptômes.
Pendant l’épidémie à norovirus il est recommandé de
tracer unecourbe dite épicourbe (fig. 2 x)enregistrant
Notreexpérience nous
montre que jusqu’à 25%
des épidémies ànorovirus
proviennent de l’extérieur L’ activité des désinfectants
pour les mains àbase
d’éthanol augmente avec
la teneur en alcool (>70%)
Ta bleau 2. Mesures d’hygiène hospitalière en cas d’épidémie à norovirus [32, 36].
Isolement des patients symptomatiques (seuls ou en groupe; en chambre à plusieurs
lits si manque de place*)
Le patient ne doit quitter sa chambre que pour des interventions diagnostiques/
thérapeutiques urgentes
Port de blouses et de gants
Port d’un masque facial (chirurgical)
Désinfection des mains par désinfectant actif contre les norovirus
Eviter de transférer les patients de services contaminés dans l’hôpital
Désinfection journalière des sols dans les services contaminés
Désinfection des toilettes/salles d’eau deux fois par jour
Désinfection finale de toute la chambre (rideaux y compris) après levée de l’isolement
Renvoyer immédiatement à la maison le personnel symptomatique (certains experts
recommandent un arrêt de travail jusqu’à 48 heures après la fin des symptômes)
*Les patients contacts ne sont transférés que si une quarantaine est possible
pour la période d’incubation (24–48 heures).
Le risque de contagion est
relativement faible si le
patient aretrouvé le contrôle
de ses exonérations

Forum Med Suisse 2010;10(4):69 69
curriculum
chaque jour les nouveaux cas. Chaque case représente
un cas. D’autres importantes informations (cas hors hô-
pital, cas avec diagnostic confirmé, etc.) peuvent égale-
ment yfigurer.Les déclarations journalières des cas à
l’hygiène hospitalière actualisent l’épicourbe. Elle donne
un aperçu actuel de l’épidémie et permet une planifica-
tion soigneuse des ressources. Les coûtsnon négligeables
des mesures d’hygiène sont àmettre en face des coûts
plus élevés d’une épidémie incontrôlée [35].
Remerciement
Je remercie cordialement le Dr Felix Fleisch, Médecin-
chef d’Infectiologie et d’Hygiène hospitalière, Kantons-
spital Graubünden, d’avoir bien voulu lire le manuscrit
et de m’avoir fait part de ses précieuses suggestions.
Correspondance:
Dr Peter Graber
Leitender Arzt Infektiologie und Spitalhygiene
Kantonsspital Liestal
Rheinstrasse 26
CH-4410Liestal
peter[email protected]h
Références recommandées
–Dolin R. Noroviruses – challenges to control. N Engl J Med. 2007;
357:1072–3.
–Fretz R, Svoboda P, Lüthi TM, Tanner M, Baumgartner A. Outbreaks
of gastroenteritis due to infections with Norovirus in Switzerland,
2001–2003. Epidemiol Infect. 2005;133:429–37.
–Schneider T, Schreier E, Zeitz M. Noroviren: häufigste Ursache infek-
tiöser Gastroenteritiden. Dtsch med Wochenschr. 2007;132:2261–6.
La liste complète des références numérotées se trouve sous
www.medicalforum.ch
Nombre
de patients
16 Personnel
15 Patientsavecdéfinitionclinique
14 PCR Patientsavecdéfinitionclinique et PCRpositive
13
12
Acquise hors de l’hôpital(communityacquired)
11
10
9
8
7
6
5
4
3PCR
2PCR
1PCR PCR PCR PCR
Janvier/février 2003 26 27 28 29 30 31 123456789101112131415161718192021
Di Lu Ma Me Je Ve Sa Di Lu Ma Me Je Ve Sa Di Lu Ma Me Je Ve Sa Di Lu Ma Me Je Ve
Epicourbe de l’épidémie ànorovirus de janvier2003
Figure 2
Exemple d’épicourbe d’une épidémie à norovirus. Les nouveaux cas y sont reportés chaque jour. Chaque case représente un cas. En jaune,
les patients remplissant la définition clinique, en orange les cas du personnel hospitalier. Les cases entourées en noir sont les cas acquis hors
de l’hôpital (community acquired). Les cas avec PCR positive peuvent être précisés.
Dans cet exemple d’une épidémie à norovirus de janvier 2003, un total de 59 cas s’est déclaré, dont 35 chez des patients et 24 chez
le personnel. 8 cas sur ces 59 ont été acquis hors de l’hôpital. Le diagnostic par PCR n’a été demandé que dans quelques cas au début
de cette épidémie.
 6
6
1
/
6
100%