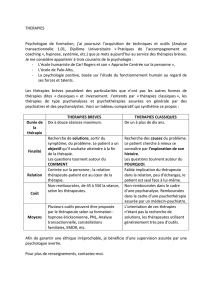
Les thérapies ciblées, qu’est-ce que c’est ? Focus What are targeted therapies?

Images en Ophtalmologie
•
Vol. XI - n° 2
•
mars-avril 2017
44
Focus
Les thérapies ciblées, qu’est-ce que c’est ?
What are targeted therapies?
A. Martel, C. Morel, J.M. Canonge, F. Puisset (Service de pharmacie, Institut universitaire du cancer, Toulouse)
L
es thérapies ciblées sont des médicaments visant
à bloquer la croissance et/ou la propagation des
cellules tumorales. Elles inhibent de manière
spécifique les mécanismes cellulaires impliqués dans
le processus de cancérogenèse.
Nouvelles approches pharmacologiques
En cancérologie, les stratégies thérapeutiques utilisées
chez les patients sont la chirurgie, la radiothérapie et la
prise en charge médicamenteuse (chimiothérapie conven-
tionnelle et thérapies ciblées). Elles peuvent être utilisées
seules ou en association. La chimiothérapie agit sans
discrimination sur les cellules en division, qu’elles soient
tumorales ou saines, ce qui engendre de nombreux effets
indésirables dose-limitants.
Les progrès de la recherche de ces 20 dernières années
sont marqués par l’amélioration de la connaissance des
voies de signalisation de la prolifération cellulaire et par
la mise en évidence d’anomalies de ces voies susceptibles
de conduire à une prolifération maligne des cellules.
De nombreuses protéines impliquées dans ces voies de
signalisation représentent ainsi de nouvelles cibles théra-
peutiques plus ou moins spécifiques d’un type de tumeur,
d’où le terme “thérapie ciblée”.
Ces molécules sont utilisées pour le traitement d’un
nombre croissant de pathologies cancéreuses. Le
cancer du poumon non à petites cellules, le cancer du
rein, les hémopathies malignes et le cancer du sein sont
les localisations disposant actuellement du plus grand
nombre de thérapies ciblées bénéficiant d’une autorisa-
tion de mise sur le marché (AMM)
[1]
.
✔
Mécanismes d’action
Les thérapies ciblées ont été développées dans les années
1990, et sont représentées par 2 catégories principales
(1)
:
•
les inhibiteurs intracellulaires : il s’agit de petites
molécules chimiques ; on y retrouve les inhibiteurs de
protéines kinases (leur dénomination se termine princi
-
palement en “nib”), qui ciblent l’activité catalytique intra
-
cellulaire des récepteurs, bloquant ainsi la transmission
du signal de prolifération cellulaire ;
•
les inhibiteurs extracellulaires : ce sont des médica-
ments biologiques dont font partie les anticorps mono-
clonaux (terminaison en “mab”). En se fixant sur leur cible,
ils empêchent la fixation du ligand sur son récepteur.
La prolifération tumorale est ainsi inhibée.
Il n’est pas simple de classer les thérapies ciblées selon
leur mode d’action, car certaines en possèdent plusieurs
(tableau I)
. Les principaux mécanismes d’action identifiés
sont les suivants
(2)
:
•
blocage de la croissance des cellules cancéreuses
en inhibant la cascade de signalisation intracellulaire.
Les 2premières thérapies ciblées ayant eu une AMM
répondent à cette catégorie : le trastuzumab, autorisé en
2000, inhibe les récepteurs HER2 surexprimés dans les
cancers du sein notamment, et l’imatinib, autorisé en 2001,
est un puissant inhibiteur de la tyrosine kinase Bcr-Abl.
Ilinhibe sélectivement la prolifération et induit l’apoptose
dans les lignées cellulaires Bcr-Abl+ (oncogène détecté
dans 95 % des cas de leucémie myéloïde chronique [LMC]) ;
•
inhibition de la formation de nouveaux vaisseaux déve-
loppés en périphérie de la tumeur qui contribueraient à
✔
Mots-clés. Thérapies ciblées • Mécanisme d’action •
Toxicité • Cancérologie.
✔
Keywords.
Targeted therapies • Pharmacological
action • Toxicity • Oncology.

Images en Ophtalmologie
•
Vol. XI - n° 2
•
mars-avril 2017
45
Tableau I. Mécanismes oncogéniques inhibés par les thérapies ciblées et biomarqueurs associés.
Mécanismes d’action Voies
oncogéniques
Thérapies ciblées
Biomarqueurs
Inhibiteurs
intracellulaires
Inhibiteurs
extracellulaires
Inhibition
de la cascade
de signalisation
intracellulaire
ALK Crizotinib, céritinib Translocation d’ALK
BCR-ABL Imatinib, bosutinib, dasatinib,
nilotinib, ponatinib Détection de BCR-ABL/
mutations d’ABL
BTK Ibrutinib
KIT
Imatinib, sunitinib, régorafénib
(bosutinib, dasatinib, nilotinib,
ponatinib, sorafénib,
pazopanib, lenvatinib,
cabozantinib)
Mutation de KIT
EGFR Erlotinib, géfinitib, afatinib,
osimertinib (vandétanib) Cétuximab,
panitumumab Mutations d’EGFR
Mutations de
KRAS et NRAS
Hedgehog Vismodégib
HER Lapatinib (afatinib) Trastuzumab,
trastuzumab emtansine,
pertuzumab Amplification d’HER2
JAK Ruxolitinib
MEK Tramétinib, cobimétinib
m-TOR Temsirolimus, évérolimus
PDGFR
Imatinib, bosutinib, dasatinib,
nilotinib, ponatinib, sorafénib,
sunitinib, régorafénib,
pazopanib, lenvatinib,
nintédanib
Mutation de PDGFRA
PI3K Idélalisib
BRAF Vémurafénib, dabrafénib
(sorafénib, régorafénib) Mutation de BRAF V600
RET Ponatinib, sunitinib,
régorafénib, lenvatinib,
vantédanib, cabozantinib
MET Cabozantinib (crizotinib)
ROS1 Crizotinib Translocation de ROS1
Inhibition
de l’angiogenèse VEGF/VEGFR
Axitinib, sorafénib, sunitinib,
pazopanib, nintédanib,
régorafénib, lenvatinib,
vantédanib, cabozantinib
(ponatinib)
Bévacizumab,
aflibercept,
ramucirumab
Réactivation
de l’immunité
Anti-PD-1
Anti-PD-L1 Nivolumab,
pembrolizumab Expression tumorale
PD-L1

Images en Ophtalmologie
•
Vol. XI - n° 2
•
mars-avril 2017
46
Focus
Tableau II. Effets indésirables des thérapies ciblées.
Toxicité Voie impliquée Médicaments Effets indésirables
Cardiaque
HER2 Trastuzumab Altération de la fonction ventriculaire
gauche
VEGF Bévacizumab, sunitinib, sorafénib… Hypertension artérielle, événement
thromboembolique,
cardiomyopathie
ABL, c-KIT, PDGFR Dasatinib Hypertension pulmonaire,
allongement du QT
ABL, ABL2, c-KIT, DDR1 Nilotinib Accidents coronariens, incidents
vasculaires, allongement du QT
ABL, ABL mutant, FGFR, VEGFR,
PDGFR Ponatinib Accidents coronariens, incidents
vasculaires
MEK1, MEK2 Tramétinib Cardiomyopathie
Cutanée
EGFR Cétuximab, panitumumab, erlotinib,
géfitinib Éruption acnéiforme, folliculite,
xérose cutanée
ABL, c-KIT, PDGRF Imatinib Éruption maculo-papuleuse,
érythrodermie, prurit
VEGF, PDGF Sunitinib, sorafénib Syndrome main-pied, hémorragies
sous-unguéales, blanchiment
des phanères, mucites
Ophtalmique
EGFR
Géfitinib Conjonctivite, blépharite, sécheresse
oculaire, perturbation de la vision
Erlotinib Conjonctivite, trichomégalie
Cétuximab Blépharite, conjonctivite, dermite
de la paupière
ABL, c-KIT Imatinib Œdème périorbitaire
CTL-A4 Ipilimumab Uvéite, papillite, inflammation
de l’iris
VEGF Bévacizumab, sorafénib, sunitinib Rétinopathie hypertensive,
neuropathie optique,
embolie rétinienne
MEK Tramétinib Altération de la perception
de la lumière, vision floue,
œdème périorbitaire
ALK, c-MET Crizotinib Altération de la vision transitoire
Digestive
VEGF Sunitinib, sorafénib Diarrhée, mucite
EGFR Erlotinib, géfitinib Diarrhée
m-TOR Évérolimus Diarrhée
Pulmonaire
EGFR Erlotinib, géfitinib Pneumopathie interstitielle
Cétuximab, panitumumab Fibrose pulmonaire, bronchiolite
PD-1/PD-L1 Nivolumab, pembrolizumab Pneumopathie interstitielle

Images en Ophtalmologie
•
Vol. XI - n° 2
•
mars-avril 2017
47
sa croissance en l’irriguant. La voie du VEGF est la mieux
connue. Le bévacizumab, le sunitinib et le sorafénib sont
des antiangiogéniques ;
•
inhibition des points de contrôle négatifs (CTLA-4,
PD-1/PD-L1) de la réponse immunitaire des lympho-
cytes T permettant de rétablir une réponse immuni-
taire efficace (ipilimumab anti-CTLA-4, pembrolizumab
anti-PD-1).
La prescription de ces traitements est guidée, dans
la mesure du possible, par les caractéristiques molé-
culaires de la tumeur de chaque patient : on parle de
“médecine stratifiée”. Des biomarqueurs peuvent être
associés à ces traitements. Ils permettent d’identifier
les patients porteurs ou non d’une altération molé culaire
(tableau I, p. 45)
.
Du mélanome métastatique à certains cancers du sein,
en passant par des pathologies digestives ou des leucé-
mies, les succès des thérapies ciblées se multiplient. C’est
notamment le cas de l’imatinib, qui a révolutionné le pro-
nostic des patients atteints de LMC
(2)
. En ophtalmologie,
l’utilisation d’anticorps anti-VEGF injectés en intravitréen
constitue une avancée thérapeutique majeure dans le
traitement des formes exsudatives de dégénérescence
maculaire liée à l’âge (DMLA). À ce jour, 3 anti-VEGF sont
disponibles pour le traitement de la DMLA : ranibizumab,
bévacizumab et aflibercept.
✔
Effets indésirables
Bien que les thérapies ciblées agissent sur des cibles
spécifiques des cellules tumorales ou de leur micro-
environnement, ces médicaments ne sont pas dénués
d’effets indésirables qui dépendent en partie de leur
mécanisme d’action. Dans la majorité des cas, ils sont
réversibles à l’arrêt du traitement et ne mettent pas
en jeu le pronostic vital. Cependant, des effets indési-
rables sévères sont observés dans une proportion non
négligeable de cas.
Les principales toxicités retrouvées sont cardio-
vasculaires
(3)
, ophtalmiques
(4)
, cutanées
(5)
, pul-
monaires et digestives
(tableau II)
[6]
. Les thérapies
ciblées, exerçant principalement un effet cytostatique
(contrairement aux chimiothérapies conventionnelles,
qui exercent un effet cytotoxique), sont administrées au
long cours pour maintenir un blocage des mécanismes
oncogéniques. La prévention et l’éducation thérapeutique
des patients sur la survenue de ces toxicités attendues
sont nécessaires pour améliorer leur prise en charge.
✔
Résistances aux thérapies ciblées
Les thérapies ciblées ont amélioré le pronostic des
patients atteints de cancer ; cependant, la survenue de
résistances est fréquemment observée. Dans un certain
nombre de cas, elles sont liées à de nouvelles mutations
sur les cibles ou sur les voies de signalisation associées.
Des thérapies ciblées de nouvelle génération sont déve-
loppées afin d’améliorer le profil de toxicité, et aussi pour
dépasser les résistances acquises avec les molécules de
première génération.
Conclusion
Un médicament anticancéreux sur 4 appartient à la classe
des thérapies ciblées. Plusieurs centaines de thérapies
ciblées sont en cours de développement. Grâce à l’avancée
de la recherche, on s’oriente vers une véritable person-
nalisation de la prise en charge des patients.
II
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références bibliographiques
1.
Institut national du cancer. Les thérapies ciblées dans le traitement
du cancer en 2015/État des lieux et enjeux, appui à la décision. INCa,
juillet 2016.
2.
Wu HC, Chang DK, Huang CH. Targeted therapy for cancer. J Cancer
Mol 2006;2(2):57-66.
3.
Moslehi JJ. Cardiovascular toxic effects of targeted cancer therapies.
N Engl J Med 2016;375(15):1457-67.
4.
Renouf DJ, Velazquez-Martin JP, Simpson R, Siu LL, Bedard PL. Ocular
toxicity of targeted therapies. J Clin Oncol 2012;30(26):3277-86.
5.
Barete S, Chosidow O. Toxicité cutanée des thérapies ciblées. La Lettre
du Cancérologue 2009;18(2):96-103.
6.
Kamioner DS. Principales toxicités des thérapeutiques ciblées. Revue
des TransAtlantiques en oncologie 2013;14-9.
1
/
4
100%