Sadiki Samedi 12 -12-2009 4ème maths et Sc-exp

Collège Sadiki
Devoir de synthèse n° : 1
Sciences physiques
4ème maths et Sc-exp
Samedi 12 -12-2009
Profs : Obey, Fkih et Cherchari
On donnera l’expression littérale avant de passer à l’application numérique.
L’utilisation de la calculatrice non programmable est autorisée.
Numéroter les questions.
Exercice 1 (5 pts):
On réalise la réaction d’estérification de l’acide éthanoïque CH3COOH par le
méthanol CH3OH à une température constante en mélangeant, à la date t=0, une mole d’acide et
une mole d’alcool, le volume du mélange est V=260 mL.
A partir de ce mélange on réalise des prélèvements identiques de volume V0=20 mL chacun, grâce
auxquels on déduit par titrage avec une solution de soude NaOH de concentration molaire
Cb=1mol.L-1 , la quantité de
matière d’ester formé.
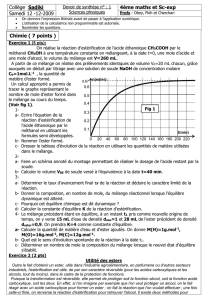
Un calcul approprié a permis de
tracer le graphe représentant le
nombre de mole d’ester formé dans
le mélange au cours du temps.
(Voir fig 1).
1-
a- Ecrire l’équation de la
réaction d’estérification de
l’acide éthanoïque par le
méthanol en utilisant les
formules semi développées.
b- Nommer l’ester formé.
c- Dresser le tableau d’évolution de la réaction en utilisant les quantités de matière utilisées
dans le mélange.
2-
a- Faire un schéma annoté du montage permettant de réaliser le dosage de l’acide restant par la
soude.
b- Calculer le volume VBE de soude versé à l’équivalence à la date t=40 min.
3-
a- Déterminer le taux d’avancement final F de la réaction et déduire le caractère limité de la
réaction.
b- Donner la composition, en nombre de mole, du mélange réactionnel lorsque l’équilibre
dynamique est atteint.
c- Pourquoi cet équilibre chimique est dit dynamique ?
d- Calculer la constante d’équilibre K de la réaction d’estérification.
4- Le mélange précédent étant en équilibre, à un instant t1 pris comme nouvelle origine de
temps, on y verse 15 mL d’eau de densité deau=1 et 28 mL de l’ester précédent de densité
dester=0,9. On prendra K=4 comme constante d’équilibre.
a- Calculer la quantité de matière d’eau et d’ester ajoutés. On donne M(H)=1g.mol-1,
M(O)=16g.mol-1, M(C)=12g.mol-1.
b- Quel est le sens d’évolution spontanée de la réaction à la date t1.
c- Déterminer en nombre de mole la composition du mélange lorsque le nouvel état d’équilibre
s’établit.
Exercice 2 (2 pts)
Utilité des esters
Outre le fait d'obtenir un ester, utile dans l'industrie agroalimentaire, en parfumerie ou d'autres secteurs
industriels, l'estérification est utile, de par son caractère réversible (pour les acides carboxyliques et les
alcools, tout du moins), dans le cadre de la protection de fonctions.
Puisque la transformation est réversible, elle permet de protéger soit la fonction alcool, soit la fonction acide
carboxylique, soit les deux. En effet, si l'on imagine par exemple que l'on veut protéger un alcool, on le fait
réagir avec un acide carboxylique pour former un ester ; on fait la réaction que l'on voulait effectuer ; une fois
celle-ci finie, on renverse la réaction d'estérification pour retrouver l'alcool. Il existe deux méthodes pour
Chimie ( 7 points )
0
20
40
60
80
100
120
140
160
180
200
220
n(ester)
0,1
0,2
0,3
0,4
0,5
0,6
0,67
t(min)
Fig 1

renverser l'estérification :
On utilise la même réaction (rétro-estérification) en jouant sur les quantités de matière pour que l'équilibre
soit favorable à l'acide carboxylique + l'alcool.
On utilise la réaction de saponification ou hydrolyse en milieu basique des esters.
Les esters sont aussi un constituant de base dans l'industrie des plastiques. Ils sont à la base d'un des
plastiques les plus utilisés, le polyester.
Les esters peuvent être hydrolysés :
* en alcools primaires par l'action du tétrahydruroaluminate de lithium (LiAlH4), dans l'éther diéthylique
(éther) ou le THF (tétrahydrofurane)
* en aldéhydes par l'action du DIBAL, dans un solvant non polaire (toluène par exemple), à basse
température (-60 °C).
Questions :
1- Définir l’estérification.
2- Ecrire l’équation générale de cette réaction.
3- Quels sont les utilités d’un ester ?
Exercice 1 ( 7 pts)
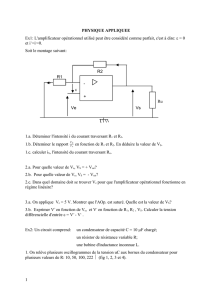
Le circuit électrique représenté par la figure ci-dessous comporte , en série, un générateur idéal
de tension de f.e.m E, une bobine d’inductance L et de résistance r=20 Ω, un interrupteur K et un
résistor de résistance R.
A la date t=0 on ferme l’interrupteur K et à l’aide d’un dispositif informatisé on a pu représenter les
variations des tensions uAB et uBC au cours du temps. (voir figures 2 et 3 page 4 à compléter et
à remettre avec la copie).
1-
a- Quelle est l’influence de l’inductance L de la bobine dans cette
expérience.
b- En exploitant les courbes de uAB et uBC, déduire, en le
justifiant, la valeur de la f.e.m E du générateur.
2-
a- Montrer qu’en régime permanent l’intensité de courant est
pE
IRr
b- Déduire alors la tension UBmin aux bornes de la bobine en
fonction de E, R et r.
c- Calculer la valeur de la résistance R.
3-
a- Donner l’expression de la constante de temps puis déterminer graphiquement sa valeur.
b- Déduire la valeur de l’inductance L de la bobine.
4-
a- Etablir l’équation différentielle régissant les variations de l’intensité de courant dans le circuit
i(t).
b- La solution de cette équation différentielle s’écrit sous la forme i=A(1- e-t ) ou A et sont
deux constantes positives dont on déterminera leurs expressions en fonction de E, r, R et L.
c- En utilisant cette solution, calculer la valeur de l’intensité i du courant dans le circuit à t=4ms.
Retrouver cette valeur à partir de l’un des graphes.
d- Calculer la valeur de l’énergie magnétique EL emmagasinée par la bobine à la date t=4 ms.
5- On reprend le montage précédent en faisant varier l’une des grandeurs E, R ou L et on ferme
l’interrupteur K à une date considérée comme origine des dates (t=0) ; en traçant le graphe
de uAB(t), on obtient la courbe (C1) ( voir figure 3 ).
a- Quelle est la grandeur qui a été modifiée ? justifier la réponse.
b- Calculer sa nouvelle valeur.
Physique ( 13 points )
R
B
L,r
A
K
C
E
i

Exercice 2 ( 6 pts)
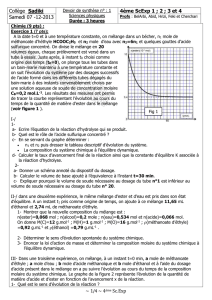
Le circuit électrique de la
figure suivante comportant un condensateur de
capacité C=3 µF initialement chargé, une bobine
d’inductance L et de résistance négligeable, un
interrupteur K et un conducteur ohmique de
résistance R.
A la date t0=0 on ferme K et simultanément un
dispositif d’acquisition informatisé se déclenche pour
enregistrer la courbe de la figure 4 représentant les variations de la tension uc(t) aux bornes du
condensateur .
1- Expliquer brièvement l’expression soulignée : le circuit est le siège d’oscillations
électriques
libres
amorties
.
2- En se servant du graphe, déterminer la pseudo période T.
3- Calculer la valeur de l’inductance L de la bobine sachant que les amortissement sont faibles et
qu’on peut considérer que la pseudopériode est pratiquement égale à la période propre du
circuit T0 . avec
0
T 2 LC
.
4- Etablir l’équation différentielle régissant les variations de la tension uC(t) aux bornes du
condensateur au cours du temps.
5-
a- Rappeler les expressions des énergies électrique Ec et magnétique EL emmagasinées
respectivement par le condensateur et par la bobine à une date t.
b- Montrer que l’énergie totale E diminue au cours du temps. Interpréter cette diminution.
c- Calculer l’énergie dissipée par effet joule dans les résistors entre les instants t0=0 et t1.
(Voir figure 4).
6-
a- Déterminer, à la date t2 , le signe de la charge de l’armature A du condensateur.
Représenter, en le justifiant, le sens du courant réel à la date t2 sur un schéma du circuit.
0
-1
t1
14 ms
t(ms)
5
uc(V)
t2
Fig 4
L
R
K
C
i
A
B

Page à compléter et à remettre avec la copie
Nom et prénom : …………………………………………… Classe : ………
0
2
4
6
8
10
12
uBC(V)
0
2
4
6
t(ms)
Fig 2
0
2
4
6
8
10
12
t(ms)
3
6
9
uAB(V)
Fig 3
C1
1
/
4
100%