Cancer de l`endomètre Liste des abréviations

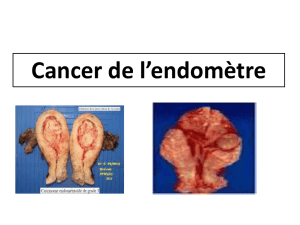
Cancer de l’endomètre
1
Liste des abréviations
ACS : American Cancer Society
CCC : Carcinome à Cellules Claires
CIN : Carcinome In Situ
CPSU : Carcinome Papillaire Séreux de l’Utérus
CSF : Colony Stimulating Factor
FIGO : Fédération International de Gynécologie Obstétrique
IGF1 : Insulin like Growth Factor
IGFBP-1 : Insulin like Growth Factor Binding Protein
ISGP : Société International de Gynéco Pathologiste
MSCF : Macrophage colony Stimulating Factor
OMS : Organisation Mondiale de la Santé
PAS : Acide Para Amino Salicylique
SHBG : Sex Hormon Binding Globulin
SOPK : Syndrome des ovaires polykystiques
TNM : Tumor Node Metastasis

Cancer de l’endomètre
2
SOMMAIRE
Chapitre I : Introduction.................................................................................. 8
Chapitre II : Revue de la littérature ................................................................. 10
A- Rappels ....................................................................................... 10
1- Embryologique ....................................................................... 10
1-1- Stade indifférencié ....................................................... 10
1-2- Stade différencié .......................................................... 11
1-3- Différenciation du vagin ............................................... 12
2- Anatomique .......................................................................... 14
2-1- Les moyens de fixité ...................................................... 15
2-2- Les rapports de l’utérus ................................................. 16
2-3- Vascularisation, innervation ........................................... 18
3- Histologique .......................................................................... 22
4- Physiologique ........................................................................ 23
4-1- Phase pré ovulatoire ...................................................... 23
4-2- Phase post ovulatoire .................................................... 23
4-3- Phase menstruelle ......................................................... 24
B- Epidémiologie .............................................................................. 25
1- Incidence .......................................................................... 25
2- Facteurs de risque .................................................................. 26
2-1- Facteurs hormonaux ...................................................... 26
a- Œstrogène et progestérone ................................. 26

Cancer de l’endomètre
3
b- Les androgènes plasmatiques et l’hyperandrogénisme
ovarien ........................................................................ 29
c- Insuline ....................................................................... 30
2-2- Tamoxifène .................................................................. 30
2-3-Obésité et distribution des graisses dans l’organisme .... 31
2-4-Parité et infertilité .......................................................... 32
2-5- Hérédité et facteurs génétiques..................................... 33
2-6- Tabagisme .................................................................... 33
2-7- Autres facteurs de risque .............................................. 33
3- Mortalité et survie .................................................................. 35
C- Anatomopathologie ..................................................................... 36
1- Etats précancéreux ................................................................. 36
2- Carcinome de l’endomètre ..................................................... 42
2-1- Aspects macroscopiques .............................................. 42
2-2- Aspects microscopiques ............................................... 43
2-3- Grades ......................................................................... 45
2-4- Extension ..................................................................... 48
D- Biologie moléculaire du cancer de l’endomètre ............................. 50
1- Pathologie moléculaire du cancer de l’endomètre ................... 50
2- Pronostic de ces altérations génétiques .................................. 52
E- Classifications ............................................................................. 53
1- Classification de la FIGO (1988) .............................................. 53
2- Classification TNM (1992) ...................................................... 55
3- Classification de l’OMS (1994) ................................................ 56
F- Dépistage .................................................................................... 57

Cancer de l’endomètre
4
1- Cytologie cervico-vaginale .................................................... 58
2- Cytologie endomètriale ......................................................... 58
3- Biopsie de l’endomètre .......................................................... 58
4- Echographie endovaginale ..................................................... 58
5- Le test aux progestatifs ......................................................... 59
G- Diagnostic positif du cancer de l’endomètre ................................. 59
1- Circonstances de survenue .................................................... 59
2- Examen clinique .................................................................... 60
3- Examens paracliniques .......................................................... 61
3-1- Echographie endovaginale ......................................... 61
3-2- Doppler couleur ......................................................... 62
3-3- Hystérographie .......................................................... 63
3-4- Hystéroscopie ............................................................ 64
3-5- Cytologie cervico-vaginale et endomètriale ................ 66
3-6- Biopsie de l’endomètre .............................................. 66
H- Bilan pré thérapeutique ............................................................... 67
1- Bilan d’extension ................................................................... 67
1-1- Appréciation de l’extension myomètriale ..................... 67
1-2- Extension au col utérin ............................................... 68
1-3- Bilan pelvien extra utérin ............................................ 69
1-4- Bilan ganglionnaire ..................................................... 70
1-5- Bilan d’extension à distance ........................................ 71
1-6- Intérêt des marqueurs tumoraux dans le bilan
d’extension ................................................................ 71
2- Bilan d’opérabilité .................................................................. 72

Cancer de l’endomètre
5
I- Facteurs pronostiques ................................................................. 74
1- Données de l’anatomopathologie........................................ 74
1-1- Grade tumoral ........................................................... 74
1-2- Type histologique de la tumeur .................................. 75
1-3- Invasion myomètriale ................................................. 75
1-4- Différenciation de la tumeur ....................................... 76
1-5- Atteinte du col ou du segment inférieur de l’utérus .... 76
2- Caractéristiques des patientes ............................................ 76
2-1- Age .......................................................................... 76
2-2- La ménopause ........................................................... 76
2-3- Facteurs raciaux ........................................................ 77
3- Facteurs pronostiques cliniques et chirurgicaux .................. 77
3-1- Stadification de la FIGO .............................................. 77
3-2- Atteinte ganglionnaire ............................................... 78
3-3- Cytologie péritonéale ................................................. 78
3-4- Atteinte vasculaire ..................................................... 79
3-5- Atteinte extra utérine ................................................. 79
3-6- Diamètre de la tumeur .............................................. 79
3-7- Envahissement des marges de résection ..................... 80
3-8- Marqueurs tumoraux ................................................. 80
3-9- Récepteurs hormonaux .............................................. 80
J- Traitement................................................................................... 81
1- Moyens thérapeutiques ................................................. 81
1-1- Chirurgie .................................................................... 81
a- Les voies d’abord ................................................ 81
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
1
/
154
100%