UE2_Bellannee_Classification_Tumorale_TNM

UE2 - Biopathologie
Dr G. Belleannée
Date : 19/11/15 Plage horaire : 14h-16 h
Promo : 2015/2016 Enseignant : Geneviève Belleannée
Ronéistes : Zoé Schott
Christophe Hoarau
LA PROGRESSION TUMORALE ET LE SYSTÈME TNM
Les modes et principales voies de progression et dissémination
tumorale
Place du pathologiste dans le bilan d’extension
Les exemples de ce cours sont donnés à titre d’exemple et ne pas apprendre par coeur!!!
I. Progression tumorale
1. Rappel sur les tumeurs
2. Dysplasie, carcinome in situ, carcinome invasif
3. Carcinome invasif
4. Histo-pronostic d’une tumeur
5. Causes de mort chez le patient cancéreux
6. Compte rendu du CRAP d’une tumeur
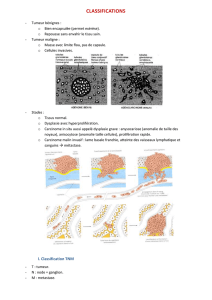
II. Classification TNM des tumeurs
1. Généralités
2. Principes généraux
3. Remarques pratiques et critiques
4. Perspectives
Conclusion

I. Progression tumorale
1. Rappels sur les tumeurs
Tumeur: prolifération cellulaire anormale avec croissance théoriquement illimitée et irréversible.
On oppose tumeur bénigne et maligne:
- Tumeur bénigne:
• délimitation nette, ronde
• refoule les tissus sans les envahir
• composition homogène
- Aspect: reproduction fidèle du tissu d’origine
Membrane basale conservée et sans infiltration
Noyaux petits, régulièrement répartis, pas de nucléoles (ou
alors très petits)
Mitoses rares et normales
- Evolution lente, locale, sans récidives après retrait,
non mortelle (sauf complication mécanique ou métabolique:
par exemple une tumeur qui secrète de l’insuline peut conduire
à de graves complications métaboliques hypoglycémiques sans
donner de métastases).
- Tumeurs malignes:
• mal limitée
• infiltre les tissus plutôt que de les repousser
• remaniements: nécrose, hémorragie...
• consistance hétérogène
- Aspect: caricature du tissu d’origine: on devine d’où elle vient mais la ressemblance avec le tissu
d’origine peut être difficile à trouver
Membrane basale: rompues: les tumeurs maligne infiltrent et dissocient les tissus bénins
Noyaux gros, irréguliers (anisocaryose), gros nucléoles
Mitoses nombreuses, anormales
- Évolution : rapide, peut donner des métastases (principal critère de malignité), récidives possibles
après retrait. Son évolution spontanée est toujours mortelle.
- Il s’agit de règles générales pouvant avoir des exceptions :
- les tumeurs malignes peuvent être très bien différenciées et ressembler de près au tissus d’origine.
Sur l’image ci-dessous on voit un filet nerveux autour duquel on voit des glandes: il s’agit d’un carcinome.
C’est ce que l’on appelle le neurotropisme. Les glandes qui sont autour ont un noyau petit, régulier, sans
mitose bien qu’il s’agisse d’un cancer du pancréas.
- les tumeurs bénignes peuvent être très atypiques, avec des noyaux très irréguliers entre eux
- les tumeurs bénignes peuvent avoir une forte activité mitotique
Le seul signe spécifique de cancer est
la métastase.
Entre le bénin (en vert, bien délimité,
n’infiltre pas) et le malin (en rouge,
infiltrant et destructeur) il peut y avoir
une étape de dysplasie (mais pas
toujours).

2. Dysplasie, carcinomes in situ, carcinome invasif
La dysplasie concerne les lésions encore bénignes (elle peut régresser spontanément et pas de potentiel
métastatique) pouvant devenir malignes. Il s’agit d’anomalies cyto-architecturale d’organisation des
cellules, de maturation et de prolifération d’intensité variable et limitées au tissu d’origine. On parle de
lésions pré-néoplasiques mais la transformation en cancer est très inconstante et se fait avec des durées
d’évolutions variables.
Ces lésions peuvent régresser. Le plus souvent elles sont dues à des anomalies génétiques qui s’accumulent
et qui peuvent être:
- héréditaires:
• syndrome de Linch,
• cancer héréditaire du côlon associé à des polypes dans le côlon se transformant
inéluctablement en cancer. Cette maladie héréditaire (on l’appelle également polypose
adénomateuse familiale) est à l’origine d’une colectomie précoce préventive (avant 30 ans).
• dans les maladies pré-néoplasiques survenant avec des anomalies acquises, on a aussi la
rectocolie hémorragique et la maladie de Crohn qui sont des maladies inflammatoires du
côlon considérées comme des maladies prénéoplasiques : elles favorisent l’apparition de
cancer.
• bilharziose: fréquentes en Afrique continentale, elles sont à l’origine de cystites pouvant se
compliquer en carcinomes de la vessie car elles provoquent une irritation chronique de la
vessie. Sur le plan histologique il s’agit de carcinomes épidermoïdes et non de carcinomes
urothéliaux.
- acquises :
• au niveau des bronches (tabagisme)
• au niveau du col de l’utérus (HPV)
La dysplasie concerne les revêtements malpighiens: par exemple les bronches, constituées d’un épithélium
cylindrique de type respiratoire. Chez le fumeur ce revêtement peut être transformé en un revêtement
malpighien: c’est ce que l’on appelle la métaplasie (transformation d’un tissu en un autre). Cette métaplasie
peut secondairement devenir carcinome épidermoïde.
Le même phénomène peut se produire au niveau du col utérin: la muqueuse exocervicale est de type
pluristratifiée malpighienne, alors que la muqueuse endocervicale sécrétant du mucus et de type cylindrique
unistratifié. De temps en temps on a ectropion: la muqueuse glandulaire passe à l’extérieur et subit une
métaplasie malpighienne. C’est là-dessus que le virus du HPV s’installe pour donner le condylome puis la
dysplasie puis le cancer du col de l’utérus.
On peut avoir également une métaplasie au niveau des revêtements glandulaires:
- lésions pré-néoplasique du sein
- adénomes du côlon (facteur favorisant: polypose, micis, Crohn...)
- œsophage métaplasique: le revêtement malpighien devient glandulaire (endobrachyœsophage) et
fragile, sujet au agressions. Il y a deux réponses aux agressions: l’inflammation, ou la transformation
néoplasique.
Les revêtements de vessies (transitionnel ou urothéliaux) peuvent également être à l’origine de lésions
prénéoplasiques (facteur favorisant: bilharziose)
Ce n’est pas compliqué, on peut en avoir sur tous les types de revêtements.
- Exemple de l’EBO (endobrachyœsophage):
Le revêtement blanc nacré correspond au revêtement
malpighien normal. De temps en temps, notamment chez les
personnes sujettes aux RGO (reflux gastro œsophagien) ce
revêtement se transforme en revêtement glandulaire: il
s’agit de métaplasie cylindrique.
Ce revêtement glandulaires est fragile et se transforme en

lésion prénéoplasiques (ou dysplasique).
Sur cette image on reconnaît facilement des cellules dysplasiques:
plus bleus car il y a plus de noyaux et les rapports
nucléocytoplasmiques sont plus élevés. Mais chaque glande reste
à sa place.
Ces lésions dysplasiques peuvent évoluer de façon non
automatique vers un carcinome infiltrant.
10-15% des EBO peut évoluer vers un adénocarcinome (risque
relatif*30 par rapport à la population générale).
La dysplasie est traitée avant l'apparition de l'adénocarcinome infiltrant c'est pourquoi les patient sous EBO
vont rentrer dans une surveillance protocolisé pour dépister la dysplasie.
En résumé:
Œsophage normal (RGO chronique) => métaplasie => dysplasie => adénocarcinome infiltrant
Le problème avec ces dysplasies, c’est que leur description n’est pas homogène : il existe une multitude de
terminologies différentes pour les décrire. Le terme le plus classique est dysplasie.
Le terme le plus moderne est néoplasie intra épithéliale (utilisation+++) ou Lésions Intra Epithéliales
(rare), abrégées LIE suivie du grade:
1. toute petite dysplasie, (léger)
2. dysplasie d’intensité moyenne (modéré)
3. dysplasie très marquée, inquiétante (sévère)
On utilise aussi une échelle à 2 grades (utilisation+++):
- bas grade
- haut grade (=carcinome in situ, carcinome intra épithélial non invasif stade 0)
Une fois qu’on a dit qu’il y a une dysplasie, qu’on a caractérisé son degré de sévérité, il faut décrire sa
localisation. La première lettre sert à cela (préfixe), par exemple:
- CIN 2: lésions de cervical intra epithelial neoplasia de grade 2 (frottis cervicaux utérins)
- PIN: prostatic intra epithelial neoplasia
- PANINI: pancreas intra epithelial neoplasia de grade 1
- Exemple du col de l’utérus :
Il s’agit d’anomalies cyto architecturales, de maturation et de prolifération: les noyaux deviennent plus gros,
plus irréguliers avec des rapports nucléo-cytoplasmiques qui augmentent. L’architecture est chamboulée: on
a les mêmes aspects sur toute la hauteur de cet épithélium.
On évalue la prolifération grâce aux mitoses. Normalement dans un revêtement malpighien elles sont
limitées à l’assise proliférante basale mais dans une lésion dysplasique on observe des mitoses sur toute la
hauteur de l’épithélium. Les mitoses sont nombreuses et anormales.
NB: comme il s’agit de dysplasie, ces mitoses sont limitées au tissu d’origine sans franchir la lame basale.
On a trois différentes façons de dénommer la dysplasie:
Les cercles rouges représentent les mitoses.
Bien sûr il ne faut pas apprendre cela, il s’agit juste
d’une illustration du fait que l’on décrive la même
chose avec différents termes.
En plus on a une très mauvaise reproductibilité
diagnostique car on essaie de mettre des catégories
avec des limites très nettes sur un processus qui est

très progressif, or tout le monde ne met pas le curseur exactement au même endroit.
L’intérêt du frotti cervico utérin (chez des femmes asymptomatiques) est de dépister les lésions
condylomateuses qui font le lit de la dysplasie et traiter avant l'apparition du carcinome infiltrant: on peut
ainsi observer le condylome, témoin de la présence du HPV, donnant de plus gros volumes aux cellules
(parfois doublés), parfois binucléées, avec de grands cytoplasmes clairs: les koilocytes. On voit très bien ce
condylome sur un frottis et sur une biopsie.
Sur la biopsie
on voit que les assises
basales commencent à
proliférer, mais sont
cantonnées au tiers
profond : il s’agit
d’une dysplasie légère
de bas grade (grade 1).
Ici, tout est basophile de la lame basale jusqu’au revêtement de surface: les 3 tiers
du revêtement sont concernés, on parle donc de CIN3 ou carcinome in situ de haut
grade.
On voit donc sur ces images l’intérêt du frottis cervico utérin systématique chez les femmes sans symptômes
pour repérer ces lésions virales: il y a rarement de dysplasie sans condylome avant:
90% des dysplasies cervicales sont liées au HPV facilement reconnaissables sur un frottis.
Voici la séquence:
1. Métaplasie: le revêtement endocervical glandulaire devient exocervical et se transforme en malpighien
fragile
2. Le virus s’installe sur ce revêtement malpighien fragile
3. Dysplasie
4. Carcinome
La métaplasie, le condylome et la dysplasie peuvent régresser, mais pas le carcinome.
Question: Qu’est-ce que le condylome?
Il s’agit d’une infection virale à HPV au niveau du col de l’utérus (un genre de verrue particulière).
Ici on a un grade sévère de dysplasie qui concerne tout le revêtement (carcinome in situ ou carcinome intra
épithélial) mais qui ne nécessite pas de chirurgie car il ne franchit pas la lame basale.
Par contre le risque est que ces cellules infiltrent les tissus sous-jacents à travers la lame basale, avec un
risque d’évolution métastatique, et destruction des tissus aux alentours.
Question : Quand on parle de carcinome ce n’est pas forcément invasif?
En anatomopathologie on peut parler de carcinome in situ. Par contre quand un clinicien pale de carcinome,
c’est presque toujours un carcinome infiltrant.
On devrait toujours préciser in situ ou invasif après carcinome.
Une fois que le carcinome est devenu invasif on a une invasion locorégionale qui se fait de proche en
Ici on devine le
condylome car le
cytoplasme est clair,
mais les mitoses sont
retrouvées plus haute
(voir la basophilie): les
deux tiers profonds sont
dédifférenciés, il s’agit
d’une CIN2 (bas
grade).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%