TUTORAT UE spé BCM 2010-2011 Séance n°4 –

2010-2011 Tutorat UE spécifiques – Bases chimiques du médicament – Séance n°4
1 / 4
HC
H
5
C
2
CCH
3
H
I
HC
H
5
C
2
CCH
3
H
II III
N
1
2
+ +
SO
2
HCl
Cl
2
ClOH SOCl
2
mil. polaire
TUTORAT UE spé BCM 2010-2011
Séance n°4 –
Semaine du
21/03/2011
Chimie organique (1) : Alcènes, Alcynes, Alcools
Pr. Roger Escale
Séance préparée par Sacha Goux, Adrien Cassar, Jean-Philippe Perrier (ATP)
Alexandre Leboucher (ATM²)
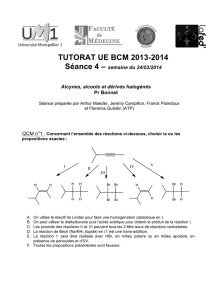
QCM n°1 :
Soit l’addition d’acide bromhydrique en milieu polaire sur le 3-deutério-2-
méthylbut-2-ène. Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) Le mécanisme est de type radicalaire.
b) La réaction fait intervenir un intermédiaire bromonium ponté.
c) On obtient un total de 4 stéréoisomères du 2-deutério-2-bromo-3-méthylbutane.
d) On obtient un total de 4 stéréoisomères du 3-deutério-2-bromo-2-méthylbutane.
e) On obtient 2 énantiomères du 3-deutério-2-bromo-2-méthylbutane.
f) Toutes les propositions précédentes sont fausses.
QCM n°2 :
Soient les deux séquences réactionnelles ci-contre :
Question A : Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) La réaction conduisant à I est régiosélective
b) La réaction conduisant à I est stéréospécifique.
c) La réaction conduisant à II est régiosélective.
d) La réaction conduisant à II est stéréospécifique.
e) La réaction conduisant à III comprend une étape SN
2
stéréospécifique.
f) Toutes les propositions précédentes sont fausses.
Question B : Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) La réaction conduisant à II fait apparaitre un carbocation intermédiaire.
b) Sans tenir compte de la stéréochimie, les produits I et III sont identiques.
c) En tenant compte de la stéréochimie, les produits I et III sont identiques.
d) Le produit III est un mélange d’énantiomères (2R*,3S*).
e) Le produit III est un mélange d’énantiomères (2R*,3R*).
f) Toutes les propositions précédentes sont fausses.
FACULTE
de
PHARMACIE

2010-2011 Tutorat UE spécifiques – Bases chimiques du médicament – Séance n°4
2 / 4
Question C : Soit le mécanisme réactionnel (en une seule étape) ébauché
ci-contre impliquant l’un des stéréo-isomères supposés du produit III, en
présence de zinc.
Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) Ce schéma évoque une réaction d’élimination de type 1.
b) Ce schéma évoque une réaction d’élimination de type 2.
c) Le produit obtenu est un monochlorure d’alkyle de configuration absolue S.
d) Le produit obtenu est un alcène de configuration E.
e) Le produit obtenu est un alcène de configuration Z.
f) Toutes les propositions précédentes sont fausses.
QCM n°3 :
L’oxydation brutale par KMnO
4
concentré et à chaud d’1 mole d’un
hydrocarbure insaturé « I » produit 1 mole d’acide acétique et 1 mole d’acide propanoïque.
D’autre part, l’halogénation de « I » est complète lorsque 2 moles de Br
2
sont absorbées
pour 1 mole d’hydrocarbure « I ». On obtient alors un produit « II ».
Question A : L’hydrocarbure « I » est :
a) Un alcène dissymétrique.
b) Un alcène symétrique.
c) Un alcyne vrai.
d) Un alcyne interne symétrique.
e) Un alcyne interne dissymétrique.
f) Toutes les propositions précédentes sont fausses.
Question B : Le produit « II » est :
a) Un mélange racémique du 1,2-dibromopentane
b) Un mélange racémique du 2,3-dibromopentane
c) Le 1,1,2,2-tétrabromopentane
d) Le 2,2,3,3-tétrabromopentane
e) Le 1,1,3,3-tétrabromopentane
f) Toutes les propositions précédentes sont fausses.
Question C : Soient les réactions suivantes dont les molécules III, IV, V, VI et VII sont à
retrouver connaissant la nature de la molécule I.
I
HOCl
I
Na
NH
3
liquide
IIII
2 HCl, milieu polaire
IV
NaOH, H
2
O
V VI
VII
C C
Cl
Cl
CH
3
H
H
5
C
2
H

2010-2011 Tutorat UE spécifiques – Bases chimiques du médicament – Séance n°4
3 / 4
Soient les 6 propositions (a, b, c, d, e, f) ci-dessous concernant la nature des molécules III à
VII. Quelles sont la ou les propositions exactes ?
a)
b)
c)
III
Cl
Cl
Et
Et
=
IV =
O
V=
OH
Cl
d)
e)
f)
VI =
O
Cl
=
VII
Toutes les propositions
précédentes sont incorrectes.
QCM n°4 :
Soit la réaction d'hydratation en présence d’acide sulfurique concentré et
catalysée par des ions mercuriques (Hg2+) d'alcynes.
a) Le propyne conduit dans ces conditions à l'acétone
b) Le dérivé obtenu existe en équilibre sous deux formes «cétonique» et «énolique» tautomères.
c) La réaction est une réaction d’addition électrophile, elle est régiosélective et suit la règle de
Markovnikov.
d) L’acétylène conduit à l’acétaldéhyde.
e) L’action de H₂O/H₂SO₄/HgSO₄ et l’addition de 1) BHR₂ 2) H₂O₂/OH⁻ sur l’acétylène conduisent au
même composé : l’acétaldéhyde
f) Un alcyne vrai, après hydratation (H₂O/H₂SO₄/HgSO₄) conduit à une méthylcétone.
g) Toutes les propositions précédentes sont fausses.
QCM n°5 :
Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) Lors de la réaction d'addition d’un dialkylborane R
2
BH sur le 4-méthylpent-2-yne puis traitement à
l’acide acétique on obtient le (2Z)-4-méthyl-pent-2-ène.
b) L’addition de 1) BHR₂ 2) H₂O₂/OH⁻ sur le butyne conduit au butanal.
c) La réaction d'hydroboration suivie d'un traitement oxydatif en milieu basique (H
2
O
2
, NaOH) résulte
en une addition type Markovnikov
d) Le (2E)-3,4,4-triméthylpent-2-ène traité par un dialkylborane R
2
BH puis après traitement
oxydatif en milieu basique (H
2
O
2
, NaOH) fournit le (2R,3S) et le (2S,3R)-3,4,4-
triméthylpentan-2-ol en mélange racémique
e) Les réactions d'hydroboration sont stéréospécifiques.
f) Toutes les propositions précédentes sont fausses.
QCM n°6 :
Soit (I) le (2E)-but-2-ène :
Dilué, à froid

2010-2011 Tutorat UE spécifiques – Bases chimiques du médicament – Séance n°4
4 / 4
Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) (II) est un mélange de (2S,3S) butane-2,3-diol et (2R,3R) butane-2,3-diol .
b) (III) est un mélange (2R*,3R*) du 2,3-époxybutane
c) (V) est le 2-chlorobutan-1-ol
d) (IV) est un mélange (2R*,3R*) du butane-2,3-diol
e) Le (2E)-pent-2-ène peut être obtenu par action du catalyseur de Lindlar de la pent-2-yne.
f) Toutes les propositions précédentes sont fausses.
QCM n°7 :
La transformation du hept-3-yne en (3E)-hept-3-ène peut être obtenue par :
a) 2 H
2
Pd désactivé
b) Na/NH
3
liquide à -78°C
c) H
2
Pd/C
d) R
2
BH puis action de l’H
2
O
2
dans la soude
e) [KMnO
4
] à chaud
f) Toutes les propositions précédentes sont fausses.
QCM n°8 :
Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) Le traitement du pentanol par l’acide bromhydrique conduit à un mélange de bromobutane
et H
2
O
b) L’action du chlorure de thionyle sur le 5-bromopentanol conduit au 1-chloro-5-
bromopentane
c) Le produit majoritaire résultant de la déshydratation acidocatalysée du 2-methylpentan-2-ol
est le 2-methylpent-2-ène
d) L’action du chlorure de thionyle dans la pyridine sur le (2R)-butan-2-ol s’effectue selon un
mécanisme SN
1
e) L’action du chlorure de thionyle dans l’éther sur le (2R)-hexan-2-ol s’effectue selon un
mécanisme SN
2
f) Toutes les propositions précédentes sont fausses.
QCM n°9 :
Le (2R)-2-bromo-phenylbutane est hydrolysé par une solution de soude diluée
et fournit I. Le produit est ensuite déshydraté à chaud en présence d’acide sulfurique
concentré et donne préférentiellement II.
a) I est un alcool secondaire.
b) Cette réaction est de type SN
1
.
c) L’hydroxyle vient se fixer à la place du brome selon l’inversion de Walden.
d) La vitesse de formation de I dépend de la concentration en soude.
e) II est un mélange de deux alcènes stéréo-isomères Z et E.
f) Toutes les propositions précédentes sont fausses.
QCM n°10 :
Quelle(s) est (sont) la (ou les) propositions(s) exactes(s) ?
a) Les alcools primaires s'oxydent en donnant des acides.
b) La déshydratation d'un alcool conduit majoritairement à l'alcène le moins substitué.
c) L'éthanol chauffé à 300°C en présence d'acide su lfurique conduit à l'éther diéthylique.
d) L'addition de l'éthanol en milieu acide sur le butène fournit le 2,3-époxybutane
e) Le 2-chloropropane en présence d'éthylate de sodium dans l'éthanol à chaud donne
préférentiellement l'oxyde d’isopropyle et d'éthyle.
f) Toutes les propositions précédentes sont fausses.
1
/
4
100%