Thermodynamique TD 1 – Calorimétrie

1/2
BioPhysique
Thermodynamique
TD 1 – Calorimétrie
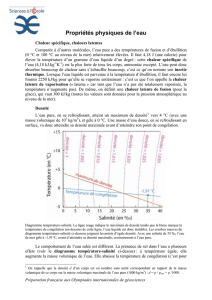
MiMo Thermodynamique S2/ Module 2 : La chaleur
Exercice 1.
Une bille d’acier de masse possède une température initiale . Celle-
ci est plongée dans une enceinte adiabatique contenant un volume d’eau
à la
température . On considérera que les capacités calorifiques de l’acier et de l’eau
sont constantes dans l’intervalle de température défini par et :
pour l’acier, et pour l’eau de masse
volumique .
Quelle est la température finale lorsque l’équilibre thermique est atteint ?
Exercice 2.
Quelle est la quantité de chaleur nécessaire pour convertir de glace à en
vapeur à ?
On donne :
Chaleur massique de l'eau :
Chaleur massique de la glace:
Chaleur latente de fusion de la glace:
Chaleur latente de vaporisation de l’eau :
Exercice 3.
Un morceau de zirconium de 300g à 200°C est introduit dans une cuve adiabatique
remplit d’un demi-litre d’une huile industrielle à 50°C. Le système évolue vers l’équilibre.
Calculer la température d’équilibre atteinte par le système (eau-zirconium)
On donne : , , .

2/2
Exercice 4.
Quelle masse de glace, initialement à une température , pourrait-on faire
fondre si on pouvait transformer intégralement en chaleur l’énergie potentielle d’une
masse située à l’altitude ?
On donne : Chaleur massique de la glace:
Chaleur latente de fusion de la glace:
Exercice 5.
Pour refroidir de jus d’orange pris à on introduit une certaine masse de glace à
. On admet qu'il n'y a échange de chaleur qu'entre la glace et le jus de fruit (rien ne se
perd vers l’extérieur). Calculer la masse de glace nécessaire pour que la température finale
de l'ensemble soit de .
On donne :
Masse volumique du jus d’orange :
Chaleur massique de l'eau :
Chaleur massique de la glace:
Chaleur massique du jus d’orange :
Chaleur latente de fusion de la glace:
Chaleur latente de vaporisation de l’eau :
Exercice 6.
On sort un bloc de plomb de masse d'une étuve à la température .
On le plonge dans un calorimètre de capacité thermique contenant une
masse d'eau. L'ensemble est à la température initiale . On mesure la
température d'équilibre thermique .
Déterminer la chaleur massique du plomb.
1
/
2
100%