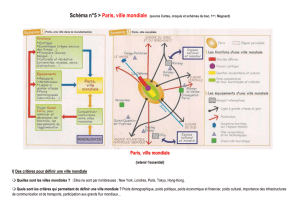
Excipients à effet notoire: sodium, 3.77 mg/ml.

CONCENTRE D’ANTITHROMBINE III BAXALTA
Résumé des caractéristiques du produit = Notice 1/8
1. DENOMINATION DU MEDICAMENT
CONCENTRE D’ANTITHROMBINE III BAXALTA, 500 UI, poudre et solvant pour solution injectable ou
pour perfusion
CONCENTRE D’ANTITHROMBINE III BAXALTA, 1000 UI, poudre et solvant pour solution injectable
ou pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Antithrombine dérivée de plasma humain.
Le CONCENTRE D’ANTITHROMBINE III BAXALTA se présente sous la forme de poudre pour solution
injectable ou pour perfusion contenant nominalement 500 UI/1000 UI d’antithrombine dérivée de plasma
humain par flacon.
Le produit contient environ 50 UI/ml (500 UI/10 ml, 1000 UI/20 ml) d’antithrombine dérivée de plasma
humain après reconstitution avec 10 ml/20 ml d’eau stérile pour préparations injectables.
Le titre (UI) est déterminé en utilisant le dosage chromogène de la Pharmacopée européenne. L’activité
spécifique du CONCENTRE D’ANTITHROMBINE III BAXALTA est au moins 3 UI AT/mg de protéines
plasmatiques.
Excipients à effet notoire: sodium, 3.77 mg/ml.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Poudre et solvant pour solution injectable ou pour perfusion.
Le CONCENTRE D’ANTITHROMBINE III BAXALTA est un solide friable ou une poudre de couleur
jaune pâle à vert pâle.
Osmolarité: non inférieure à 240 mOsmol/kg, pH : 6,0 – 7,5.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
La déficience en antithrombine peut être congénitale ou acquise dans le cadre d’une grande variété de
désordres cliniques. Une déficience acquise en antithrombine peut être due, soit à une consommation accrue
ou à une perte de protéines, soit à une synthèse déficiente de l’antithrombine.
L’administration du CONCENTRE D’ANTITHROMBINE III BAXALTA est indiquée chez les patients
avec une activité plasmatique d’antithrombine inférieure à 70 % de la normale, pour la prophylaxie et le
traitement des troubles thrombotiques et thromboemboliques. Les perfusions d’antithrombine peuvent être
indiquées dans les situations cliniques suivantes:
•procédures chirurgicales, ou grossesse et accouchement chez des patients avec déficience
congénitale en antithrombine;
•réaction inadéquate ou absence de réaction à l’héparine;
•existence ou risque de coagulation intravasculaire disséminée (p.ex. avec trauma multiple,
complications septiques, choc, prééclampsie et autres troubles associés à une coagulation
intravasculaire disséminée aiguë);
Version 7.0 (QRD 3.0)

CONCENTRE D’ANTITHROMBINE III BAXALTA
Résumé des caractéristiques du produit = Notice 2/8
•existence ou risque de thrombose chez les patients avec syndrome néphrotique ou maladie
intestinale inflammatoire;
•intervention chirurgicale ou hémorragies chez les patients avec insuffisance hépatique sévère, en
particulier si les patients sont traités avec des concentrés de facteurs de coagulation.
4.2. Posologie et mode d’administration
Le début du traitement doit être supervisé par un médecin spécialisé dans le traitement des patients avec des
déficits d’antithrombine.
Posologie
En cas de déficience congénitale, la posologie doit être individualisée pour chaque patient en prenant en
compte les antécédents familiaux en ce qui concerne les événements thromboemboliques, les facteurs de
risque clinique actuels, et l’évaluation du laboratoire.
La posologie ainsi que la durée du traitement de substitution des déficits acquis dépendent du taux
plasmatique d’antithrombine, de la présence de signes de production augmentée, des troubles sous-jacents, et
de la sévérité de l’état clinique du patient. La quantité à administrer et la fréquence d’administration doivent
toujours être basées sur l’efficacité clinique et l’évaluation du laboratoire dans le cas de l’individu.
Le nombre d’unités d’antithrombine administrées est exprimé en Unités Internationales (UI), qui sont en
rapport avec le standard actuel de l’OMS pour l’antithrombine. L’activité d’antithrombine dans le plasma est
exprimée en pourcentage (par rapport au plasma humain normal) ou en Unités Internationales (par rapport au
Standard International pour l’antithrombine dans le plasma).
Une Unité Internationale (UI) d’activité d’antithrombine correspond à la quantité d’antithrombine contenue
dans 1 ml de plasma humain normal. Le calcul de la dose requise d’antithrombine se fonde sur la
constatation que 1 Unité Internationale (UI) d’antithrombine par kg de poids corporel élève l’activité
plasmatique d’antithrombine d’environ 2 %.
La dose initiale est déterminée en utilisant la formule suivante:
unités requises = poids corporel (kg) x (taux que l’on souhaite atteindre – activité actuelle en
antithrombine [%]) x 0,5
L’activité en antithrombine initiale que l’on souhaite atteindre dépend de la situation clinique. Lorsque
l’indication pour la substitution d’antithrombine est établie, le dosage doit être suffisant pour atteindre
l’activité voulue en antithrombine, et pour maintenir un taux efficace. Le dosage doit être déterminé et
contrôlé sur base des mesures de laboratoire de l’activité en antithrombine qui doivent être effectuées au
moins deux fois par jour jusqu’à ce que le patient soit stabilisé, ensuite une fois par jour, de préférence
immédiatement avant la perfusion suivante. La correction du dosage doit prendre en compte les signes de
production augmentée d’antithrombine selon les contrôles de laboratoire, ainsi que l’évolution clinique.
L’activité en antithrombine doit être maintenue au-dessus de 80 % pendant la durée du traitement, à moins
que des particularités cliniques n’indiquent un taux d’efficacité différent.
La dose initiale habituelle en cas de déficience congénitale devrait être de 30 – 50 UI/kg.
Population spéciale
La posologie et la fréquence, ainsi que la durée du traitement doivent être ajustées selon les données
biologiques et la situation clinique.
Population pédiatrique
La
sé c u r it
é et l
’ e f fi
c a c it
é du
CONCENTRE D’ANTITHROMBINE III BAXALTA
chez d e s p a t
i e n t
s en
Version 7.0 (QRD 3.0)

CONCENTRE D’ANTITHROMBINE III BAXALTA
Résumé des caractéristiques du produit = Notice 3/8
pé d i
a t r i
e n ’
ont pas été ét a b l i
es lo r s d e s é t
ud e s cl i niq u es d e Baxalta. Toutefois, l’utilisation de solutions
d’Antithrombine III dans la population pédiatrique est référencée dans la littérature médicale.
Mode d’administration
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Le produit doit être administré par voie intraveineuse. La vitesse maximale d’administration est de 5 ml par
minute.
4.3. Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1. Passé médical
connu de thrombocytopénie induite par l’héparine.
4.4. Mises en garde spéciales et précautions d’emploi
Comme tout produit contenant des protéines injecté par voie intraveineuse , des réactions allergiques de
type hypersensibilité peuvent apparaître. Les patients doivent être surveillés de près et faire l’objet d’une
observation consciencieuse, afin de détecter tout symptôme pendant toute la perfusion. Les patients doivent
être informés des signes précoces des réactions d’hypersensibilité telles qu’urticaire localisée, urticaire
généralisée, oppression thoracique, respiration sifflante, hypotension et anaphylaxie. Si ces symptômes
apparaissent après l’administration, les patients doivent contacter leur médecin.
En cas de choc, les standards médicaux doivent être instaurés.
Les mesures standards pour éviter les infections résultant de l’utilisation de médicaments préparés à base de
sang ou de plasma humain incluent la sélection des donneurs, le dépistage des dons individuels et des
regroupements de plasma pour des signes spécifiques d’infection et l’inclusion d’étapes de production
efficaces pour l’inactivation/l’élimination de virus. Malgré ces mesures, lorsque des médicaments préparés à
base de sang ou de plasma humain sont administrés, la possibilité de transmission d’agents infectieux ne peut
être totalement exclue. Ceci est également valable pour les virus inconnus ou émergents et pour d’autres
pathogènes.
Les mesures prises sont considérées efficaces pour les virus enveloppés tels que VIH, VHB et VHC, ainsi
que pour le virus non enveloppé VHA. Les mesures prises peuvent avoir une valeur limitée face aux virus non-
enveloppés tels que le parvovirus B19. Une infection par le parvovirus B19 peut être sérieuse pour les femmes
enceintes (infection fœtale) et pour les personnes souffrant d’immunodéficience ou d’une production
augmentée de globules rouges (p.ex. en cas d’anémie hémolytique).
Une vaccination appropriée (hépatite A et B) doit être considérée pour les patients qui reçoivent
régulièrement/de façon répétée des produits d’antithrombine dérivée de plasma humain.
Chaque fois que le CONCENTRE D’ANTITHROMBINE III BAXALTA est administré à un patient, il est
fortement recommandé de noter le nom et le numéro de lot du produit, afin de conserver un lien entre le
patient et le numéro de lot du produit.
Surveillance clinique et biologique lorsque l’antithrombine est utilisée en association avec l’héparine:
•Afin d’ajuster le dosage d’héparine et d’éviter une hypocoagulabilité excessive, des contrôles de
l’étendue de l’anticoagulation (APPT, et activité anti-FXa lorsqu’approprié) doivent être effectués
régulièrement, à des intervalles proches et plus particulièrement pendant les premières
minutes/heures après le début de l’utilisation de l’antithrombine.
Mesure quotidienne des taux d’antithrombine, afin d’ajuster la dose individuelle, à cause du risque
de diminution des taux d’antithrombine suite au traitement prolongé avec de l’héparine non
fractionnée.
Ce m édica m ent co n ti e nt env i
ron 3,77 m g de sodium par m l
. Ceci do i t ê t
re p r is e n cons i dé r a t ion p our les
pa t i
e n ts s u i v ant u n ré g i
m e à ta u x de sod i um contr ô lé.
Version 7.0 (QRD 3.0)

CONCENTRE D’ANTITHROMBINE III BAXALTA
Résumé des caractéristiques du produit = Notice 4/8
Popul a t
i on pé d i
a t
r i
que
La sécurité et l’efficacité du concentré d’Antithrombine III Baxalta chez des patients en pédiatrie n’ont pas
été établies lors des études cliniques de Baxalta. Toutefois, l’utilisation de solutions d’Antithrombine III
dans la population pédiatrique est référencée dans la littérature médicale.
Les données d’essais cliniques et de revues systématiques concernant l’utilisation de l’antithrombine III
dans le traitement de bébés prématurés pour l’indication non approuvée de syndrome de détresse
respiratoire du nouveau-né (SDR) suggèrent un risque accru d’hémorragie intracrânienne et de
mortalité en l’absence d’un effet bénéfique démontré.
4.5. Interactions avec d’autres médicaments et autres formes d’interaction
Héparine: La substitution d’antithrombine pendant l’administration de l’héparine en dosage thérapeutique
augmente le risque de saignement. L’effet de l’antithrombine est considérablement renforcé par l’héparine.
La demi-vie de l’antithrombine peut être fortement diminuée avec un traitement concomitant à l’héparine, ce
qui est dû à l’élimination accélérée. C’est pourquoi l’administration simultanée d’héparine et
d’antithrombine à un patient avec un risque élevé de saignement doit être contrôlée d’un point de vue
clinique et biologique.
4.6. Fécondité, grossesse et allaitement
L’expérience concernant la sécurité des produits d’antithrombine humaine pour utilisation au cours de la
grossesse chez les humains est limitée.
La sécurité d’emploi du CONCENTRE D’ANTITHROMBINE III BAXALTA chez la femme enceinte ou
allaitant n’a pas été établie dans des études cliniques contrôlées.
Le CONCENTRE D’ANTITHROMBINE III BAXALTA ne doit être administré aux femmes enceintes ou
allaitant souffrant d’une déficience en antithrombine que si cela est clairement indiqué, en prenant en
considération que la grossesse confère un risque accru d’événements thromboemboliques chez ces patients.
4.7. Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Le CONCENTRE D’ANTITHROMBINE III BAXALTA n’a aucun effet ou qu’un effet négligeable sur
l’aptitude à conduire des véhicules et à utiliser des machines.
4.8. Effets indésirables
Résumé du profil de sécurité
Aucun effet indésirable lié n’a été rapporté au cours des essais cliniques.
Des réactions d’hypersensibilité ou allergiques (pouvant inclure angio-œdème, brûlure et picotements au
point d’injection, frissons, rougeur, urticaire généralisée, maux de tête, démangeaisons, hypotension,
léthargie, nausées, agitation, tachycardie, oppression thoracique, fourmillements, vomissements et respiration
sifflante) ont été observées de façon peu fréquente et peuvent, dans certains cas, évoluer en une anaphylaxie
sévère (incluant le choc).
De rares cas de fièvre ont été observés.
La thrombocytopénie auto-immune induite par l’héparine (type II) peut apparaître dans de rares cas. Une
numération thrombocytaire de moins de 100 000/µl ou une diminution de la numération thrombocytaire de
50 % peut être observée.
L’expérience post-commercialisation relative au CONCENTRE D’ANTITHROMBINE III BAXALTA
a fait état des effets indésirables suivants: tremblements, bouffée de chaleur.
Version 7.0 (QRD 3.0)

CONCENTRE D’ANTITHROMBINE III BAXALTA
Résumé des caractéristiques du produit = Notice 5/8
Tableau des effets indésirables
Les effets indésirables sont repris selon la Classification des systèmes d’organes (CSO) de MedDRA, puis
selon les termes recommandés par ordre de gravité lorsque cela était possible.
La fréquence a été évaluée selon la convention suivante : très fréquent (≥1/10) ; fréquent (≥1/100 à
<1/10) ; peu fréquent (≥1/1 000 à <1/100) ; rare (≥1/10 000 à <1/1 000) ; très rare (<1/10 000) ;
inconnu (ne peut être estimé sur base des données disponibles).
F r
é qu
e n
c e d
e s
e ff
et s ind
é si
r a bl
e s
Classi f
i
cation des
syst è
m es d’organes
Me d
DRA
Te r
m inologie MedDRA
F r
é qu
e n
c e d
e s
e ff
et s
ind
é si
r a bl
e s
Affections hématologiques et
du système lymphatique
Thrombocytopénie Rare
Affections du système
immunitaire
Reactions d’hypersensibilité ou
allergiques (pouvant inclure angio-
œdème, brûlure et picotements au
point d’injection, frissons, rougeur,
urticaire généralisée, maux de tête,
démangeaisons, hypotension,
léthargie, nausées, agitation,
tachycardie, oppression thoracique,
fourmillements, vomissements et
respiration sifflante)
Peu
f r
équent
Affections du système
nerveux
Tremblements* Fréquence
Indéterminée
(ne peut pas
être estimée à
partir des
données
disponibles)
Affections vasculaires Bouffée de chaleur* Fréquence
Indéterminée
(ne peut pas
être estimée à
partir des
données
disponibles)
Troubles généraux et
anomalies au site
d'administration
Fièvre Rare
*Effets indésirables post-commercialisation
Version 7.0 (QRD 3.0)
 6
6
 7
7
 8
8
 9
9
1
/
9
100%