I. Pression dans les gaz II. Pression atmosphérique

pression dans les gaz et pression atmosphérique
Lycée E. Jacqmain - Vanden Abeele - Physique 3° 1 2008-2009
Interprétation cinétique de l’existence de la pression exercée par les gaz:
Dans un gaz, les molécules se déplacent à grande vitesse à travers
tout le récipient. Les molécules viennent donc frapper les parois
et y rebondissent.
Les parois sont donc soumises à un ensemble de forces :
les forces
pressantes.
Si l’on considère un élément de paroi soumis à cette
force pressante, on peut donc calculer la pression du gaz
pressante
F
pS
Facteurs influençant la valeur de la pression exercée par un gaz.
Si la température augmente , la vitesse moyenne des molécules augmente, les
chocs sont donc « plus forts », la pression augmente.
Si le volume du récipient est diminué, le parcours entre 2 chocs successifs est
plus court, le nombre de chocs par seconde est plus élevé et la pression
augmente.
La Terre est entourée d’une couche d’air qui est un mélange de gaz. Cette couche
d’air constitue l’atmosphère.
Tout comme les liquides, l’atmosphère qui nous entoure exerce des forces
pressantes sur nous ainsi qui sur les faces de tous les objets.
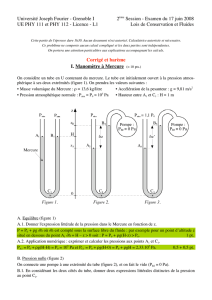
1. Expérience historique des hémisphères de Magdebourg
I. Pression dans les gaz
II. Pression atmosphérique
L'expérience des hémisphères de
Magdebourg. Deux hémisphères a et b
peuvent s'appliquer étroitement l'un
contre l'autre pour constituer une
cavité sphérique hermétiquement
close lorsque le robinet, R, est fermé.
Après avoir fait le vide à l'intérieur de
cette cavité, on ne peut séparer les
hémisphères qu'en appliquant en M et
N des forces capables de vaincre les
forces pressantes atmosphériques et
dont l'intensité est d'autant plus
grande que la surface de base des
hémisphères est plus grande. Quand
cette expérience fut réalisée pour la
première fois par Otto de Guericke, le
maire de Magdebourg (Allemagne) en
1654, avec des hémisphères de grand
diamètre, il fallut la force de huit
chevaux, tirant de part et d'autre,
pour les séparer.

pression dans les gaz et pression atmosphérique
Lycée E. Jacqmain - Vanden Abeele - Physique 3° 2 2008-2009
2. Mise en évidence de la pression atmosphérique :
Expérience
obs
Le papier ne tombe
pas
encre ne s’écoule pas
en pressant la
ventouse, l’air est
chassé ; la
ventouse « colle »
CCl
peau < patm
patm n’agit que sur
l’orifice inférieur
la patm extérieure
agit seule sur la
ventouse
obs
le carton tient
toujours
l’encre s’écoule
malgré les poids,
elle tient tjs
CCL
la patm s’exerce
dans toutes les
directions
la patm agit des 2
côtés, son effet
s’annule. Seule la
pesanteur provoque
l’écoulement
La patm est forte
Applications :
1. Explique le fonctionnement d’une paille. Pourquoi est-il plus difficile d’aspirer
s’il y a un petit trou ?
2. Explique pourquoi l’œuf « contorsionniste » entre-t-il
dans la bouteille ?
eau
papier
encre
ventouse

pression dans les gaz et pression atmosphérique
Lycée E. Jacqmain - Vanden Abeele - Physique 3° 3 2008-2009
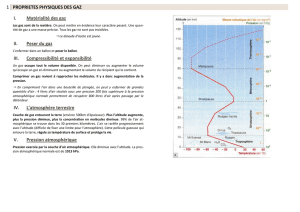
3. Mesure de la pression atmosphérique
Expérience :
Remplissons de mercure un tube d’environ 1 m longueur. Bouchons le tube avec
le doigt et renversons-le dans une cuve contenant du mercure.
Observation :
Le mercure descend et se stabilise à une hauteur de 760 mm.
Observation :
Quelle que soit l’inclinaison ou la forme du tube, la hauteur
est la même.
Conclusion :
C’est la pression atmosphérique qui exerce sur la surface libre du liquide de la
cuve une force qui équilibre le poids de la colonne de mercure contenu dans le
tube.
Calcul :
La pression atmosphérique est égale à la pression exercée par cette colonne de
mercure de 76 cm de hauteur.
kg
13600 m³
patm= 13600 . 9,81 . 0,76 = 101396,16 Pa
Unités de mesure :
l’atmosphère (atm ) : 1 atm = pression atmosphérique normale
le mm de mercure : 1 atm = 76 cm ou 760 mm de mercure
le millibar (mb) / bar : 1 mb = 1 hPa
1 atm = 1013 mb
Instruments de mesure :
Le baromètre
à mercure
métallique
1
/
3
100%