Chapitre C2 – L`AIR

Chapitre C2 – L’AIR
Dans ce chapitre, nous allons :
- Apprendre la composition de l’atmosphère
- Mesurer la masse d’1 litre d’air
- Etudier la force exercée par l’air : la
pression atmosphérique
.
I. LA COMPOSITION DE L’AIR
1. L’atmosphère terrestre.
L’atmosphère terrestre est une couche d’air qui entoure la Terre
sur une épaisseur de 600 km environ. L’air de l’atmosphère se
raréfie à mesure que l’altitude augmente. On distingue 5 couches :
- La troposphère : contient les ¾ de l’air atmosphérique
qui permettent la vie sur Terre.
- La stratosphère : c’est là que se trouve la couche
d’ozone, bouclier protecteur contre la majorité des rayons
ultraviolets (UV)
- La mésosphère :
- La thermosphère et l’ionosphère (non représentée sur le
schéma) : dans ces zones, les températures sont très
élevées.
1. Qu’est-ce que l’atmosphère terrestre ? c’est une couche d’air.
2. Dans quelle couche de l’atmosphère vivons-nous ?
Nous vivons dans la troposphère.
3. Comment appelle-t-on la couche protectrice contre les rayons
UV ? elle s’appelle la couche d’ozone.
4. Pourrions-nous vivre dans une autre couche de l’atmosphère ?
non.
2. La composition de l’air.
Activité – vidéo Lesitetv : « Mélanges : Lavoisier et la composition de l’air »
Mélanges :
LAVOISIER
et
la composition de l’air
Questions :
1) Quel est le nom du père de la chimie moderne ? Son nom est Antoine Laurent de Lavoisier
2) Quels sont son lieu et son année de naissance ? Il est né à paris en 1743
3) En quelle année est-il décédé ? Et comment ? Il est guillotiné le 8 mai 1794.
4) Sous le règne de quel Roi a-t-il vécu ? Il a vécu sous le règne de Louis XVI.

5) Avant Lavoisier, on pensait que la matière était composée de quatre éléments. Lesquels ?
Les 4 éléments étaient le feu, l’air, la terre et l’eau.
6) Dans sa célèbre expérience, quel liquide utilise-t-il ? Il utilise du mercure.
7) Après 12 jours d’expérience, quels changements apparaissent ?
- Des parcelles rouges apparaissent dans la cornue.
- La quantité d’air a diminué.
8) Quel est l’effet de l’air résiduel de la cloche sur les animaux ? Quel nom lui donne-t-il alors ?
L’air résiduel tue les animaux. Il l’appelle azote………………………………………………………….
9) Quel est le nom du second gaz ? pourquoi le nomme-t-il ainsi ?
Le second gaz est appelé oxygène, car il attaque les métaux (du grec « oxys » = acide).
Activité :
Dans le chapitre précédent, on a vu que l’état
gazeux est un état désordonné et dispersé.
En déduire une schématisation de l’air dans le
récipient ci-contre (celui de gauche)
Bilan :
L’air est un mélange de gaz :
- dioxygène (20%)
- diazote (80 %)
Il y a 4 fois plus de diazote que de dioxygène.
Le gaz indispensable à la vie est le dioxygène.
Dioxygène
Diazote

II. LES PROPRIETES DE L’AIR (TP propriétés de l’air)
1. La pression de l’air
Voir vidéo lesitetv : pression et baromètre
E. TORRICELLI (1608-1647)
PRESSION :
Le baromètre
Blaise PASCAL (1623-1662)
Questions :
1) En 1640, quel était le problème rencontré par les
fontainiers de Florence ? Il était impossible de pomper de
l’eau à plus de 10 m de hauteur………………
2) Qui s’intéressa à ce problème ? Evangelista
TORRICELLI………………
3) De qui était-il le disciple ?
De Galileo GALILEE…………………
4) Dans son expérience, quel liquide utilise-t-il ?
Il utilise du mercure…………
5) Quelle expérience réalise d’E. TORRICELLI ? Il
retourne un tube de mercure dans une cuve remplie de
mercure ……………………………………………………
6) Qu’observe-t-il alors ? comment l’explique-t-il ?
Il observe que le mercure du tube ne tombe pas dans la
cuve et observe une hauteur de 76 cm de mercure dans le
tube.
7) Quel scientifique français s’intéresse alors aux travaux de d’E.
TORRICELLI ? BLAISE PASCAL
8) Quelle est son idée ?
Son idée est de réaliser l’expérience en altitude………
9) Quel résultat obtient-il ?
La hauteur de mercure dans le tube dépend de l’altitude…
10) Quel nom donne-t-on au tube d’E. TORRICELLI ?
on le nomme BAROMETRE…………
11) Quel hommage est rendu à Blaise PASCAL ?
On donne son nom à l’unité de la Pression………………

Activité : Comment évolue la pression pendant la compression d’un gaz ?
Rends-toi sur le blog de sciences physiques :
http://blog.crdp-versailles.fr/pcblaisepascal,
Dans la partie du blog dédiée aux 4èmes, rends-toi sur le
chapitre C2 – L’air et ses propriétés.
Pour accéder à la simulation, clique sur l’image :
Déplace le piston, et mesure la pression obtenue pour
différents volumes :
Pour V1 = 50 mL, P1 = 1000 hPa
Pour V2 = 30 mL, P2 = 1666 hPa…
Pour V3 = 10 mL, P3 = …5000 hPa
1. Lorsqu’on appuie sur le piston de la seringue :
- Comment varie le volume ? …………………….il diminue
- comment varie la pression ? ……………………..elle augmente
2. Lorsqu’on tire le piston :
- comment varie le volume ? ………………………il augmente
- comment varie la pression ? ………………………elle diminue
3. De quoi peut dépendre la pression d’un gaz ? a) de la température b) du nombre de molécules
Bilan : La pression d’un gaz est due aux chocs des molécules contre des surfaces.
La pression d’un gaz dépend :
- Du volume
- De la température
- Du nombre de molécules
Quand le volume diminue, la pression augmente
Quand le volume augmente, la pression diminue
La pression se mesure avec un manomètre en Pascal.
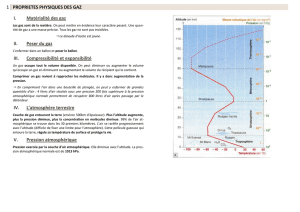
La pression atmosphérique normale est :
P = 1013 hPa = 101300 Pa

Application : Le baromètre est utilisé en météorologie pour
mesurer la pression de l’air atmosphérique. Cette pression donne
une indication sur le temps qu’il fait.
a. Que mesure un baromètre ?
La pression atmosphérique
b. Quel est son rôle ?
Indiquer le temps qu’il fait.
c. D’après la photo :
- Compare la pression atmosphérique par beau temps à la
pression atmosphérique normale (rappel : 1013 hPa) ?
Elle est supérieure à 1013 hPa
- Compare la pression atmosphérique par mauvais temps à la
pression atmosphérique normale (rappel : 1013 hPa) ?
Elle est inférieure à 1013 hPa
Un peu d’histoire : La pression atmosphérique peut se mesurer
avec le baromètre de TORRICELLI.
Evangelista TORRICELLI remplit de mercure un tube de verre de
1m et le retourna au-dessus d’une cuve de mercure.
A la pression atmosphérique normale, la colonne de mercure a
une hauteur de 76 cm.
d. Comment varie la hauteur de la colonne de mercure par
beau temps ? explique. Elle augmente car la pression
atmosphérique étant élevée, l’air pousse sur le
mercure.
2. L’air a-t-il une masse ?
Pour répondre à cette question, nous allons utiliser la technique de la « récupération d’un gaz par
déplacement d’eau ».
Image récupéré sur le manuel Hachette.
1) Mesurer la masse du ballon avant : m1 = 603 g
2) Mesurer la masse du ballon après : m2 = 599 g
3) Pourquoi peut-on déduire de ces 2 mesures (Q. 1 et 2) que
l’air a une masse ? car le ballon a perdu de l’air et sa
masse a alors diminué.
4) Quel est le volume de l’air récupéré dans la bouteille ? 3 L
5) Quelle est la masse de l’air récupéré dans la bouteille ?
603-599 = 4 g
6) En déduire la masse de 1 L d’air : 4/3 =1,33 g
Bilan : 1L d’air a une masse de 1,2 g
 6
6
1
/
6
100%