Chapitre 3 : pression dans les gaz – pression

Date :
Lycée E. Jacqmain - Vanden Abeele - Physique 3° / 2013-2014
Séquence 2 : la pression
12
Chapitre 3 : pression dans les gaz –
pression atmosphérique
I. Pression dans les gaz
Interprétation cinétique de l’existence de la pression
exercée par les gaz:
Dans un gaz, les molécules se déplacent à grande vitesse à
travers tout le récipient. Les molécules viennent donc
frapper les parois et y rebondissent.
Les parois sont donc soumises à un ensemble de forces :les
forces pressantes. Si l’on considère un élément de paroi
soumis à cette force pressante, on peut donc calculer la
pression du gaz
pressante
F
p= S
Facteurs influençant la valeur de la pression exercée par un gaz.
Si la température augmente, la vitesse moyenne des molécules augmente, les
chocs sont donc « plus forts », la pression augmente.
Si le volume du récipient est diminué, le parcours entre 2 chocs successifs est plus
court, le nombre de chocs par seconde est plus élevé et la pression augmente.
II. Pression atmosphérique
Rappel : La Terre est entourée d’une couche d’air qui est un mélange de gaz. Cette couche d’air
constitue l’atmosphère. Tout comme les liquides, l’atmosphère qui nous entoure exerce des forces
pressantes sur nous ainsi qui sur les faces de tous les objets.
1. Expérience historique des hémisphères de Magdebourg
L'expérience des hémisphères de
Magdebourg. Deux hémisphères a et b
peuvent s'appliquer étroitement l'un
contre l'autre pour constituer une
cavité sphérique hermétiquement
close lorsque le robinet, R, est fermé.
Après avoir fait le vide à l'intérieur de
cette cavité, on ne peut séparer les
hémisphères qu'en appliquant en M et
N des forces capables de vaincre les
forces pressantes atmosphériques et
dont l'intensité est d'autant plus grande
que la surface de base des hémisphères
est plus grande. Quand cette
expérience fut réalisée pour la première
fois par Otto de Guericke, le maire de
Magdebourg (Allemagne) en 1654, avec
des hémisphères de grand diamètre, il
fallut la force de huit chevaux, tirant de
part et d'autre, pour les séparer.

Lycée E. Jacqmain - Vanden Abeele - Physique 3° / 2013-2014
13 Séquence 2 : la pression
2. Mise en évidence de la pression atmosphérique :
1. Expérience du verre d’eau du carton :
Observation : Le carton ne tombe pas
Explication : peau < patm F p air > F p eau + Pcarton
Observation : le carton tient toujours
Explication : la patm s’exerce dans toutes les directions.
2. Expérience de la bouteille que l’on vide de l’air qu’elle contient :
Expérience : Vidons une bouteille en plastique de l’air qu’elle contient.
Observation : Tant que l’on aspire, la bouteille se déforme ; elle s’écrase sur elle-même. Lorsqu’on
arrête d’aspirer, la bouteille reste déformée mais aucun mouvement ne s’opère.
Explication :
1. Lors de l’aspiration, la pression interne diminue et devient donc plus petite que la pression
(atmosphérique) à l’extérieur de la bouteille. La bouteille subit donc une force pressante plus
importante sur la paroi extérieure (vers l’intérieur) que sur la paroi intérieure (vers l’extérieur). la
paroi se déplace vers l’intérieur.
2. Dans le même temps, le volume intérieur de la bouteille diminue et la pression interne va donc
augmenter.
Conclusion : La pint est donc = patm ext pendant l’écrasement de la bouteille.
eau
papier
eau
carton
carton

Lycée E. Jacqmain - Vanden Abeele - Physique 3° / 2013-2014
14 Séquence 2 : la pression
1. Mesure de la pression atmosphérique :
Expérience de Torricelli :
Remplissons de mercure un tube d’environ 1 m
longueur. Bouchons le tube avec le doigt et
renversons-le dans une cuve contenant du mercure.
Observation :
Le mercure descend et se stabilise à une hauteur
d’environ 760 mm.
Conclusion :
C’est l’atmosphère qui exerce sur la surface libre du liquide de la cuve une force pressante qui
équilibre le poids de la colonne de mercure contenu dans le tube.
Calcul :
La pression atmosphérique est égale à la pression exercée par cette colonne de mercure de 76 cm de
hauteur.
Hg
kg
13600 m³
patm= 13600 . 9,81 . 0,76 = 101396,16 Pa
Remarques :
Observation :
Quelle que soit l’inclinaison ou la forme du tube, la hauteur est la
même.
Unités de mesure :
l’atmosphère (atm ) : 1 atm = pression atmosphérique normale
le mm de mercure : 1 atm = 76 cm ou 760 mm de mercure
le millibar (mb) / bar : 1 mb = 1 hPa
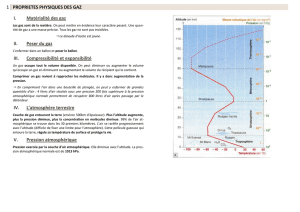
1 atm = 1013 mb
1
/
3
100%