Activité historique atome et correction

2
nde
Activité : quelques épisodes de l’histoire du modèle de l’atome
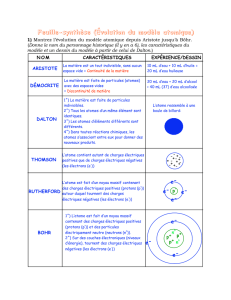
Les philosophes grecs anciens, menés par Aristote, considéraient que la « nature des choses » s’expliquait par un
savant mélange de quatre éléments : le feu, l’air, l’eau et la terre.
De l’atome de Démocrite aux atomes de Dalton.
Au V
e
siècle avant Jésus-Christ, des philosophes grecs (Leucippe, Démocrite) affirment que la matière est
constituée d’entités très petites et indestructibles qu’ils appellent atomes (grec:
atomos
- que l’on ne peut pas
diviser). Ils pensent que les propriétés de ces atomes, en constant mouvement dans le vide, sont déterminées par
leur taille et leur forme. Démocrite est persuadé que les atomes sont ronds et crochus, lisses ou rugueux ; ils
s’assemblent pour former les objets qui nous entourent. Il n’a aucune preuve expérimentale de ce qu’il avance.
Au Moyen-Âge, l’alchimie se développe sans que les conceptions atomistes des grecs n’aient beaucoup d’influence.
Il faut attendre le début du XIX
e
siècle pour qu’un scientifique anglais, John Dalton, reprenne l’hypothèse
atomique. Il la formule alors en cinq points :
Toute la matière est constituée d’atomes ;
Tous les atomes d’un élément donné sont identiques ;
Les atomes d’éléments différents ont des masses différentes ;
Un composé est une combinaison particulière d’atomes d’un ou plusieurs éléments ;
Dans une réaction chimique, les atomes ne sont jamais créés ou détruits, ils ne font que se réarranger
pour former de nouveaux composés.
L’hypothèse de Dalton permet d’interpréter les résultats expérimentaux de l’époque, à savoir que dans une réaction
chimique, la masse se conserve et les réactifs réagissent toujours dans des proportions bien définies.
À notre époque, nous disposons de moyens pour « voir » les atomes : l’hypothèse atomique de Dalton s’avère exacte.
En définitive, les atomes ont été inventés avant d’être observés uniquement parce que l’hypothèse de leur existence
permettait d’expliquer un certain nombre de faits expérimentaux.
A la découverte d’une particule mystérieuse.
En 1895, le Britannique William Crookes (1832-1919) réalise une expérience qui va
se révéler importante pour élargir les connaissances de l’atome. Il utilise un tube
en verre dans lequel l’air est raréfié (la pression est faible). Dans ce tube sont
placées deux électrodes, entre lesquelles il applique une tension électrique
d’environ 10 kV.
Pour une pression suffisamment faible, il observe un rayonnement issu de la
cathode et provoquant une luminescence sur les parois en verre du tube. Il donne
à ce rayonnement le nom de « rayons cathodiques ». Crookes montre que ces
rayons sont électriquement chargés, car ils sont déviés par le champ magnétique
créé par un aimant.
En 1897, le Britannique Joseph John Thomson (1856-1940) prouve
expérimentalement que les « rayons cathodiques » sont des courants de
particules (objets de dimensions extrêmement petites) portant une charge
négative. Dans le tube de Crookes, ces particules sont arrachées à la cathode.
J. J. Thomson propose alors un modèle dans lequel il compare l’atome à une sorte
de gâteau aux raisins : l’atome est une boule sphérique, fourrée de particules de
charge négative. Dans un matériau solide comme l’or ou le fer, ces sphères sont
empilées de façon à occuper un volume minimal.
Particules de
charge négative

Le modèle de l’atome de Rutherford.
En 1909, la structure de l’atome reste encore du domaine des hypothèses. Le physicien britannique Ernest
Rutherford (1871-1937) réalise une expérience décisive : il bombarde une feuille d’or très fine avec des particules
α émises par un corps radioactif. Les particules α sont des atomes d’hélium ayant perdu deux électrons. Elles sont
beaucoup plus petites que les atomes d’or. Rutherford considère que la feuille d’or est constituée d’environ 1 000
couches parallèles d’atomes.
Il observe que seule une infime minorité de particules α semble rebondir sur la feuille d’or : une sur 100 000. La
grande majorité des particules α ne sont pas déviées par la traversée de la feuille.
En 1910, Rutherford propose un modèle planétaire de l’atome. Il compare l’atome au système solaire l’atome est
constitué d’un noyau, autour duquel gravitent les électrons. Le noyau est 10
4
à 10
5
fois plus petit que l’atome.
L’atome, c’est-à-dire l’édifice constitué par le noyau et les électrons, est donc constitué de beaucoup de vide, Il est
par ailleurs électriquement neutre.
Depuis l’expérience de Rutherford, les scientifiques ont pu préciser la structure du noyau et le modèle de l’atome
s’est perfectionné, permettant de prédire de mieux en mieux le comportement de la matière.
Questions
1. Le philosophe grec Démocrite parlait d’atomes « crochus ». Expliquer pourquoi.
Quelle est la signification de l’expression « avoir des atomes crochus » dans le langage courant ?
2. Pourquoi la théorie des atomes est-elle restée aussi longtemps en sommeil ?
3. Existe-t-il une différence fondamentale entre les théories de Démocrite et de Dalton sur l’atome ?
4. Quel est le nom de la particule mise en évidence par Thomson ?
5. Si l’on considère que, dans le tube de Crookes, ces particules sont extraites des atomes et que l’atome est
électriquement neutre, que peut-on en déduire pour les autres composants de l’atome ?
6. Quelle est la différence fondamentale entre le modèle de l’atome de Thomson et la vision de l’atome
qu’avait Démocrite ?
7. Dans un jeu de billard, à quelle condition une boule change-t-elle de direction ?
8. Si les atomes d’or étaient des sphères pleines et jointives, comme le proposait Thomson, est-il probable que
la grande majorité des particules α traversent la feuille d’or sans être déviées ?
9. Qu’a pu en déduire Rutherford sur la répartition de la matière dans l’atome ?
10. Depuis quelques années, de nouvelles particules ont été mises en évidence : les « quarks ».
Qu’en est-il, en quelques mots ?

Quelques épisodes de l’histoire du modèle de l’atome
- Correction -
1. Le philosophe grec Démocrite parlait d’atomes « crochus ». Expliquer pourquoi.
Il pensait que les atomes pouvaient se lier, s'accrocher entre eux pour former la matière.
Quelle est la signification de cette expression dans le langage courant ?
« Avoir des atomes crochus » signifie avoir des affinités ou des centres d'intérêts en commun avec quelqu'un.
2. Pourquoi la théorie des atomes est-elle restée aussi longtemps en sommeil ?
D'une part, la validité de cette théorie ne pouvait pas être prouvée car les avancées techniques et scientifiques
n'étaient pas suffisantes ; d'autre part, la notoriété d'Aristote qui propose de classer la matière en 4 éléments (le
feu, l'air, l'eau et la terre) oriente les alchimistes dans une mauvaise voie.
3. Existe-t-il une différence fondamentale entre les théories de Démocrite et de Dalton sur l’atome ?
D’un point de vue philosophique, la différence ne semble pas fondamentale car pour les deux théoriciens la matière
est composée d’atomes assemblés les uns aux autres. Dalton base d’ailleurs ses travaux sur les hypothèses émises
par Démocrite.
La différence notable repose sur la notion d’élément et de combinaison d’éléments : là où Démocrite voyait des
atomes ronds d’eau liquide, des atomes crochus d’eau sous forme de glace et de petits atomes lisses de vapeur
d’eau, Dalton voyait une combinaison d’atomes d’oxygène et d’hydrogène, et cela, quelque soit l’état physique de
l’eau.
4. Quel est le nom de la particule mise en évidence par Thomson ?
Thomson met en évidence une particule qu'il appelle "électron".
5. Si l’on considère que, dans le tube de Crookes, ces particules sont extraites des atomes et que l’atome est
électriquement neutre, que peut-on en déduire pour les autres composants de l’atome ?
Si les électrons sont chargés négativement et que l'atome est électriquement neutre, alors la charge globale des
autres composants de l'atome est positive.
6. Quelle est la différence fondamentale entre le modèle de l’atome de Thomson et la vision de l’atome qu’avait Démocrite ?
Démocrite pensait qu'il n'y avait rien de plus petit que l'atome, alors que pour Thomson l'atome était formé de
plusieurs constituants, donc divisible. De plus, Thomson met en évidence la notion de charges électriques dans
l’atome.
7. Dans un jeu de billard, à quelle condition une boule change-t-elle de direction ?
La boule change de direction si elle rencontre un obstacle.
8. Si les atomes d’or étaient des sphères pleines et jointives, comme le proposait Thomson, est-il probable que la grande
majorité des particules α traversent la feuille d’or sans être déviées ?
Non, la grande majorité des particules α auraient été déviées comme des boules de billard rencontrant un obstacle.
9. Qu’a pu en déduire Rutherford sur la répartition de la matière dans l’atome ?
Rutherford a pu déduire que les différents constituants de l’atome n'étaient pas jointifs et que l'atome admettait
donc une structure lacunaire (beaucoup de vide et peu de particules dans le volume occupé par un atome).
10. Depuis quelques années, de nouvelles particules ont été mises en évidence : les « quarks ».
Qu’en est-il, en quelques mots ?
Les quarks sont les composants des protons et des neutrons qui forment le noyau de l'atome. La théorie des quarks
date de 1964 et ces particules ont été mises en évidence expérimentalement en 1975. Il en existe deux types dans
la matière ordinaire : les quarks "up" (symbole : u et charge électrique : + 2/3 e) et les quarks "down" (symbole : d
et charge électrique : -1/3 e).
Protons et neutrons sont formés de 3 quarks :
proton (u + u + d donnant une charge + e)
neutron (u + d + d donnant une charge nulle).
1
/
3
100%