Feuille-synthèse (Évolution du modèle atomique)

Feuille-synthèse (Évolution du modèle atomique)
Feuille-synthèse (Évolution du modèle atomique)
1) Montrez l’évolution du modèle atomique depuis Aristote jusqu’à Böhr.
(Donne le nom du personnage historique (il y en a 6), les caractéristiques du
modèle et un dessin du modèle à partir de celui de Dalton.)
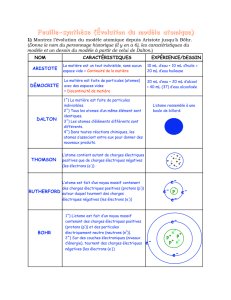
NOM CARACTÉRISTIQUES EXPÉRIENCE/DESSIN
ARISTOTE
La matière est un tout indivisible, sans aucun
espace vide = Continuité de la matière
10 mL d’eau + 10 mL d’huile =
20 mL d’eau huileuse
DÉMOCRITE
La matière est faite de particules (atomes)
avec des espaces vides
= Discontinuité de matière
20 mL d’eau + 20 mL d’alcool
< 40 mL (37) d’eau alcoolisée
DALTON
1˚) La matière est faite de particules
indivisibles.
2˚) Tous les atomes d’un même élément sont
identiques.
3˚) Les atomes d’éléments différents sont
différents.
4˚) Dans toutes réactions chimiques, les
atomes s’associent entre eux pour donner des
nouveaux produits.
L’atome ressemble à une
boule de billard:
THOMSON
L’atome contient autant de charges électriques
positives que de charges électriques négatives
(les électrons (e-))
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
-
RUTHERFORD
L’atome est fait d’un noyau massif contenant
des charges électriques positives (protons (p+))
autour duquel tournent des charges
électriques négatives (les électrons (e-))
p+
e-
e-
e-
e-
BOHR
1˚) L’atome est fait d’un noyau massif
contenant des charges électriques positives
(protons (p+)) et des particules
électriquement neutre (neutrons (n0)).
2˚) Sur des couches électroniques (niveaux
d’énergie), tournent des charges électriques
négatives (les électrons (e-))
p+
p+
p+
n0
n0
e-
e-
e-

2) Quel fut l’apport de Roger Bacon (1214-1294)? Il fut le premier scientifique.
Il considérait que l’observation et l’expérimentation sont les chemins qu’il
faut emprunter lorsqu’on veut comprendre la structure de la matière.
3) a) Quelle phrase célèbre fut prononcé par Antoine Laurent de Lavoisier?
“Rien ne se perd, rien ne se crée.”
b) Quelle loi cette phrase illustrait-elle? La loi de conservation de la matière.
4) a) Quelle est la loi “des proportions définies” de Joseph Proust (1754-
1826)? “Les éléments se combinent entre eux toujours avec les mêmes
proportions pour former un composé.”
b) Donnez un exemple: Cela prendra toujours 2 atomes de l’élément
hydrogène (H) avec 1 atome de l’élément oxygène(O) pour former le composé
eau (H2O).
5) a) Quelle est la loi “des proportions multiples” de John Dalton (1766-
1844)? “Si deux éléments se combinent pour former un seul composé connu,
alors ce composé résulte de la combinaison d’un atome du premier élément
avec un atome du deuxième élément. Lorsque deux éléments peuvent former
deux composés, le premier composé résulte de la combinaison d’un atome de
chaque élément, alors que le deuxième composé résulterait d’un rapport
différent.”
b) Donnez un exemple: Avec les éléments carbone (C) et oxygène (O), on peut
former 2 composés différents: le monoxyde de carbone (CO) et le dioxyde de
carbone (CO2).
6) Qui fut le premier chercheur a observé l’électrostatisme? Le grec Thalès de
Millet À quelle époque? 600 avant Jésus-Christ.
7) Quelle fut la découverte de Henri Becquerel ((1852-1908)? La radioactivité.
8) a) Quelle fut la découverte de James Chadwick (1891-1974)? des particules
de masse presqu’égale à celle d’un proton et n’ayant pas de charge électrique
nette.
b) Quel nom donna-t-il à cette particule élémentaire? des neutrons (n0)
1
/
2
100%