Les équilibres

3OS
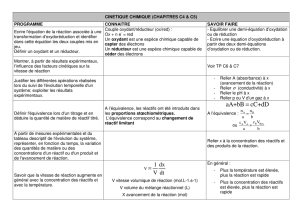
1. Les notions à acquérir
1.1 Vocabulaire à apprendre à maîtriser dans ce chapitre
réactif produit équilibre chimique
conditions expérimentales système système fermé
système ouvert réversible irréversible
état d’équilibre réaction directe réaction inverse
réaction complète réaction totale vitesse de réaction
milieu homogène milieu hétérogène loi d’action de masse
constante d’équilibre équilibre homogène équilibre hétérogène
principe de Le Châtelier catalyseur
1.2 Compétences à acquérir au cours de ce chapitre
A la fin de ce chapitre vous devrez être capable de
• Poser et équilibrer l’équation chimique d’une réaction réversible.
• Identifier les composants appelés produits et réactifs d’une réaction réversible.
• Déterminer, si une réaction est réversible ou totale, soit à partir de son équation
chimique, soit à partir de la description de la réaction.
• Identifier les réactions directe et inverse.
• Définir ce qu’est un état d’équilibre.
• Citer les caractéristiques d’un état d’équilibre.
• Citer les facteurs influençant la vitesse d’une réaction.
• Expliquer comment se comportent les vitesses des réactions directe et inverse hors
et à l’état d’équilibre.
• Poser les lois de vitesse de Guldberg et Waage, pour une réaction réversible.
• Appliquer la loi d’action de masse à un système à l’équilibre.
• Expliquer pour quelles raisons l’état d’équilibre n’est pas synonyme de l’arrêt des
réactions chimiques.
• Citer les facteurs pouvant perturber un état d’équilibre et discuter leur effet sur l’état
d’équilibre.
• Résoudre une équation du second degré à une inconnue.
• Ecrire l’expression de la constante d’équilibre d’une réaction réversible, en fonction
des concentrations des réactifs et des produits.

3OS
Les équilibres chimiques
2
• Calculer la constante d’équilibre d’une réaction réversible à partir de concentrations
connues à l’équilibre.
• Exprimer et calculer la constante d’équilibre d’une réaction réversible dont les
coefficients stoechiométriques sont des multiples des coefficients les plus petits
possibles (§ 5.3 remarque point a)).
• Savoir que si Ke est définit pour A B, alors pour B A, Ke’ = 1/Ke.
• Citer le(s) facteurs influençant et n’influençant pas la constante d’équilibre.
• Calculer la concentration d’un des composants à l’équilibre en connaissant la valeur
de la constante d’équilibre et le nombre de mole ou la concentration des autres
composants à l’équilibre.
• Interpréter qualitativement la valeur de la constante d’équilibre et ainsi déterminer si
le mélange réactionnel à l’équilibre contient majoritairement des réactifs ou des
produits ou ni l’un ni l’autre.
• Calculer les concentrations des réactifs et/ou des produits, à l’équilibre, en
connaissant le nombres de moles ou la concentration des réactifs au départ, ainsi
que la valeur de la constante d’équilibre.
• Calculer les concentrations des réactifs, au départ, en connaissant le nombre de
moles ou la concentration des réactifs et/ou des produits à l’équilibre.
• Définir ce qu’est le quotient réactionnel.
• Déterminer les situations qui requièrent l’utilisation du quotient réactionnel.
• Ecrire l’expression du quotient réactionnel
• Comparer la valeur du quotient réactionnel avec la valeur de la constante d’équilibre
et ainsi déterminer et décrire la manière dont le système se comportera pour arriver
à l’état d’équilibre.
• Calculer la concentration des réactifs et/ou des produits, à l’équilibre, en connaissant
le nombre de moles ou la concentration des réactifs et des produits au départ, ainsi
que la valeur de la constante d’équilibre, après avoir utiliser le quotient réactionnel.
• Citer le principe de Le Châtelier.
• Déterminer l’effet de la modification d’un ou plusieurs facteurs influençant l’état
d’équilibre.
• Décrire qualitativement, mais de manière détaillée étape par étape, pour chaque
facteur influençant l’équilibre, l’impact sur le système et le comportement de ce
dernier, si un ou plusieurs de ces facteurs sont modifiés.
2. Introduction
Les réactions chimiques que vous avez rencontrées jusqu’à présent, sont des réactions
qui évoluent jusqu'à la disparition totale d’au moins un des réactifs. Ces réactions sont
dites réactions complètes ou totales.
En réalité, la majorité des réactions chimiques ne sont pas totales, car elles cessent de
progresser, alors que seule une partie des réactifs a été transformée. Lors de telles
réactions, les réactifs et les produits coexistent en permanence sans que l'on observe une
variation de leur concentration. On définit cet état en disant qu'il y a équilibre chimique.

3OS
Les équilibres chimiques
3
3. Les réactions réversibles
Si on étudie la réaction de l’acide chlorhydrique gazeux (HCl) et du gaz oxygène (O
2
),
l'expérience montre que, dans un système fermé :
• si on mélange, à chaud, les gaz HCl et O
2
, il se forme de l'eau et du gaz dichlore (Cl
2
).
• si on mélange, à chaud, c’est-à-dire dans les mêmes conditions expérimentales que la
réaction précédente, les produits de la réaction précédente H
2
O et Cl
2
, il se forme HCl
et O
2
.
Entre ces quatre corps purs, il peut donc se produire :
1) HCl et O
2
donnent Cl
2
et HCl : O
2(g)
+ 4 HCl
(g)
2 H
2
O
(g)
+ 2 Cl
2(g)
2) Cl
2
et H
2
O donnent HCl et O
2
: 2 H
2
O
(g)
+ 2 Cl
2(g)
O
2(g)
+ 4 HCl
(g)
Autrement dit :
Si on fait réagir de l’acide chlorhydrique avec de l’oxygène, de l’eau et du chlore vont se
former O
2(g)
+ 4 HCl
(g)
2 H
2
O
(g)
+ 2 Cl
2(g)
(1)
Puis lorsque l’eau et le chlore seront formés, ils vont réagir ensemble pour former de
l’oxygène et de l’acide chlorhydrique.
2 H
2
O
(g)
+ 2 Cl
2(g)
O
2(g)
+ 4 HCl
(g)
(2)
Dans notre récipient, les deux réactions suivantes auront donc lieu en même temps.
1) O
2(g)
+ 4 HCl
(g)
2 H
2
O
(g)
+ 2 Cl
2(g)
(1)
2) 2 H
2
O
(g)
+ 2 Cl
2(g)
O
2(g)
+ 4 HCl
(g)
(2)
Comme la réaction 2) est la réaction inverse de la réaction 1) et que les deux réactions ont
lieu dans les mêmes conditions expérimentales, on dit que la réaction est réversible. On
traduit cette réversibilité de la réaction par une double flèche dans l’équation chimique :
O
2(g)
+ 4 HCl
(g)
2H
2
O
(g)
+ 2 Cl
2(g)
(3)
Remarques:
A) Voilà deux réactions:
2 H
2
O
(l)
2 H
2(g)
+ O
2(g)
et 2 H
2(g)
+ O
2(g)
2 H
2
O
(g)
Ces dernières sont des réactions opposées, mais elles ne NE sont PAS réversibles,
car elles ne peuvent pas avoir lieu simultanément, dans les même conditions
réactionnelles et donc dans le même récipient.
B) Dans l’équation chimique d’une réaction réversible, la réaction représentée par la
flèche allant de gauche à droite , s’appelle la réaction directe. La réaction
représentée par la flèche allant de droite à gauche s’appelle la reaction
inverse.

3OS
Les équilibres chimiques
4
4. L’état d’équilibre
3.1 L’évolution des concentrations lorsqu’il y a un équilibre chimique
Continuons avec notre réaction 3). Puisque la réaction est réversible, les réactifs, ici HCl
et O
2
côtoient en permanence les produits, Cl
2
, H
2
O et la réaction ne se termine jamais.
Si on mesure à intervalles réguliers, les concentrations des réactifs et des produits, on
obtient le résultat suivant:
0
1
Temps
Concentration
Autrement dit:
Après un certain temps et, théoriquement pour une durée infinie, la réaction cesse
d’évoluer et toutes les concentrations restent constantes.
On dit alors que notre réaction aatteint l’état d’équilibre.
3.2 L’équilibre chimique est un équilibre dynamique
Il est TOTALEMENT FAUX de conclure que, puisque toutes les concentrations sont
constantes, alors les deux réactions se sont arrêtées.
EQUILIBRE = ARRET DU SYSTEME
Pour que les réactions chimiques aient lieu les molécules doivent entrer en collision, puis
échanger leurs atomes.
A l’état d’équilibre, les réactifs et les produits sont tous présents, ils entrent donc en
permanence en collision et échangent donc leur atomes pour former de nouvelles

3OS
Les équilibres chimiques
5
molécules. Les réactions chimiques ont donc toujours lieu. Des concentrations
constantes n’impliquent donc pas un arrêt des réactions.
Des concentrations constantes indiquent que la disparition des réactifs par la réaction
directe (1) se fait simultanément à leur formation par la réaction inverse (2). Idem pour les
produits.
Les deux réactions, la réaction directe (1) et la réaction inverse (2) continuent donc à
l’équilibre, mais elles ont lieu toutes les deux à la même vitesse.
3.3 Système ouvert versus système fermé
Nous avons spécifié au début de notre expérience que nous utilisions un système fermé.
En effet, si notre expérience est effectuée dans un système ouvert, les gaz formés
peuvent s’échapper du système et de ce fait la réaction inverse 2) ne peut plus avoir lieu.
La réaction directe (1) n’est plus réversible et l’état d’équilibre n’est jamais obtenu.
Exemples de systèmes fermés:
Une bonbonne aérosol est un exemple de milieu fermé. Il y a équilibre entre le liquide et le
gaz contenus dans la bonbonne. Si on laisse sortir le gaz en pesant sur la valve, le
système devient ouvert et il n'y a plus équilibre.
Une solution saturée de sucre est un exemple de milieu isolé. Les molécules de sucre ne
peuvent certainement pas quitter la solution
C
12
H
22
O
11 (s)
C
12
H
22
O
11 (aq)
5. Vitesse de réaction
4.1 Introduction
Certaines réactions chimiques sont instantanées (réactions de précipitation, de
neutralisations, etc.), d'autres sont moins rapides (combustion du charbon, du pétrole dans
l'air), et certaines tellement lentes qu'elles peuvent se dérouler sur plusieurs heures voire
plusieurs jours (oxydation du fer, du cuivre).
D'une façon générale, la vitesse d'une réaction chimique est exprimée par la variation de
la concentration molaire des substances réagissantes par seconde.
sl
mol
V
C
tempsduiation ionconcentratladeiation
v•
=
∆
∆
== var
var
4.2 Quelques facteurs influençant la vitesse de réaction
Chaque réaction s'effectue avec une vitesse qui dépend d'un certain nombre de facteurs
comme par exemple :
• La température :
Dans la majorité des cas la vitesse des réactions augmente avec la température (elle
double à peu près pour une élévation de 10°C). En effet l'agitation moléculaire croît
avec la température et les chocs entre molécules sont plus fréquents et plus violents
ce qui ‘’facilite’’ les réactions.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%