Une matière colorante est une substance qui, en - Physique

Correction de l'exploitation de l'expérience 3 faite en TP
Expérience 3 :
13. Exprimer puis calculer les quantités de matière initiales des réactifs pour l’expérience n°3.
Calcul de la quantité de matière de diiode :
n(I2) = C1.V1
n(I2) = 1,0 x 10-2 x 25 x 10-3
n(I2) = 2,5 x 10-4 mol
La quantité de matière initiale de I2 est de 2,5 x 10-4 mol.
Calcul de la quantité de matière d'ions S2O32-:
n(S2O32-) = C2.V2
n(S2O32-) = 1,0 x 10-2 x 40 x 10-3
n(I2) = 4,0 x 10-4 mol
La quantité de matière initiale de S2O32- est de 4,0 x 10-4 mol.
L'évolution d'un système chimique au cours d'une transformation chimique peut être décrite dans un tableau tel que celui présenté
ci-dessous. Dans ce tableau (dit "tableau d'avancement"), on note la quantité de matière des différentes espèces chimiques (réactifs
et produits) à différents moments de la transformation.
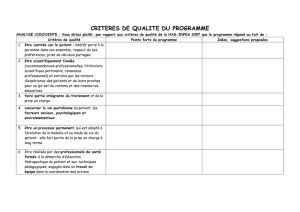
14. Compléter la ligne « État initial » avec les valeurs des quantités initiales des réactifs et des produits, exprimées en mol.
Équation de la réaction chimique 1 I2(aq) + 2 S2O32- → 2 I- + 1 S4O62-
Avancement
(en mol) n(I2) n(S2O32-) n(I-) n(S4O62-)
État initial x = 0 2,5. 10-4 4,0. 10-4 0 0
État intermédiaire x
(1)
2,5. 10-4 - x
(2)
4,0. 10-4 - 2x
(3)
2 x
(4)
x
État final littéral xmax 2,5. 10-4 - xmax 4,0. 10-4 - 2xmax 2 xmax xmax
État final numérique 2,0. 10-4 0,5. 10-4 0 4,0. 10-4 2,0. 10-4
15. Dans les cases (1) et (2), exprimer en fonction de la quantité initiale du réactif et de l’avancement x, les quantités de matière
restantes des réactifs. De la même façon, compléter les cases (3) et (4) puis l’avant dernière ligne du tableau.
16. Déterminer la valeur de l’avancement maximal et le réactif limitant.
Si le diode est le réactif limitant :
2,5. 10-4 - x max = 0
D'où x max = 2,5. 10-4 mol
Si les ions thiosulfates sont le réactif limitant :
4,0. 10-4 - 2x max = 0
D'où x max = 2,0. 10-4 mol
On déduit de ces deux calculs que les ions thiosulfates s'épuisent avant le diode, pour un avancement x max = 2,0. 10-4 mol. Le
réactif limitant est donc les ions thiosulfates.
17. La réponse à la question précédente est-elle conforme aux observations expérimentales ? Justifier.
La solution obtenue en fin de réaction est jaune pâle. On en déduit qu'il reste du diode en solution et que c'est donc les ions
thiosulfate S2O32- qui s'épuisent les premiers. Le résultat de la question 16 est donc conforme aux observations
expérimentales.
18. On considère le mélange constitué des quantités initiales suivantes : n0(I2) = 2,0 x 10-4 mol et n0(S2O32-) = 4,0 x 10-4 mol
a. A votre avis, pourquoi dit-on que les réactifs sont introduits dans les proportions stœchiométriques ?
D'après les nombres stoechiométriques qui apparaissent dans l'équation de la réaction, les ions thiosulfates sont consommés à
un rythme 2 fois plus important que les molécules de diode puisque chaque fois qu'une molécule de diode réagit, 2 ions
thiosulfates réagissent. Pour qu'il n'y ait pas de réactifs en excès en fin de réaction, il faut donc introduire 2 fois plus d'ions
thiosulfates que de molécules de diodes. On choisit des proportions cohérentes avec les nombres stoechiométriques.
b. Déterminer pour ce mélange la valeur de l’avancement maximal et le réactif limitant.
L'avancement maximal est ici de 2,0 x 10-4 mol et les deux réactifs sont limitants.
19. Retour sur la question posée au début du TP : A quelle condition l’alcootest devient-il totalement de couleur verte ?
L'alcootest devient complètement vert si l'éthanol n'est plus le réactif limitant de la réaction et qu'il ne reste plus d'ions
dichromates oranges.
1
/
1
100%