TP7 : Prévoir la couleur d`un mélange

840901691 Page 1 sur 1 16/04/17
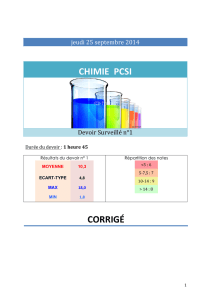
Date :
T1
Activité expérimentale
Compétences expérimentales
ST2-1
Prévoir la couleur d’un mélange…
s’ APPROPRIER
A
B
C
D
ANALYSER
A
B
C
D
RÉALISER
A
B
C
D
VALIDER
A
B
C
D
COMMUNIQUER
A
B
C
D
ÊTRE… et FAIRE PREUVE…
A
B
C
D
Objectifs : Utiliser tes connaissances pour RÉALISER les calculs nécessaires ce qui de permettra de mieux ANALYSER le problème et proposer une
méthode de prédiction.
PROBLEMATIQUE
Voici deux mélanges possibles :
Mélange n°1
Mélange n°2
5,0 mL de solution de
diiode I2 de concentration
6,0.10-3 mol/L
10,0 mL de solution d’ions
thiosulfate S2O32- de con-
centration 1,0.10-2 mol/L
10,0 mL de solution de
diiode I2 de concentration
6,0.10-3 mol/L
5,0 mL de solution d’ions
thiosulfate S2O32- de con-
centration 1,0.10-2 mol/L
Comment pouvait-on prévoir les couleurs finales des deux mélanges ?
Pour aller plus loin : que contiennent les deux mélanges après réaction ? Il serait bon de faire un bilan de matière...
INFORMATIONS - CONSEILS
- Le diiode I2 est la seule espèce chimique colorée présente dans cette expérience. Il donne une teinte jaune-brun.
- Le diiode réagit avec les ions thiosulfates selon l’équation chimique : 1 I2 + 2 S2O32- → 2 I- + 1 S4O62- .
- Pour faciliter la réflexion, il est possible d’exprimer les quantités de matière en micromoles : 1 µmol = 10-6 mol.
- Au sujet du protocole : préparer les solutions dans des tubes à essais avant d’effecteur les mélanges. Les volumes
seront prélevés à l’aide d’une pipette jaugée.
DEMARCHE
A toi de mettre en ouvre le protocole proposé afin de répondre aux questions posées.
Pistes de réflexion
- En observant l’état final, on peut en déduire le réactif en défaut, appelé aussi réactif limitant, et le réactif en excès.
- Il est possible, pour chaque mélange, de calculer les quantités de matières initiales ni(I2) et ni(S2O32-) des réactifs.
- N’est-il pas possible de prévoir la couleur finale du mélange à partir de ces quantités initiales ?
Date :
T1
Activité expérimentale
Compétences expérimentales
ST2-1
Prévoir la couleur d’un mélange…
s’ APPROPRIER
A
B
C
D
ANALYSER
A
B
C
D
RÉALISER
A
B
C
D
VALIDER
A
B
C
D
COMMUNIQUER
A
B
C
D
ÊTRE… et FAIRE PREUVE…
A
B
C
D
Objectifs : Utiliser tes connaissances pour RÉALISER les calculs nécessaires ce qui de permettra de mieux ANALYSER le problème et proposer une
méthode de prédiction.
PROBLEMATIQUE
Voici deux mélanges possibles :
Mélange n°1
Mélange n°2
4,0 mL de solution de
diiode I2 de concentration
6,0.10-3 mol/L
8,0 mL de solution d’ions
thiosulfate S2O32- de con-
centration 1,0.10-2 mol/L
8,0 mL de solution de
diiode I2 de concentration
6,0.10-3 mol/L
4,0 mL de solution d’ions
thiosulfate S2O32- de con-
centration 1,0.10-2 mol/L
Comment pouvait-on prévoir les couleurs finales des deux mélanges ?
Pour aller plus loin : que contiennent les deux mélanges après réaction ? Il serait bon de faire un bilan de matière...
INFORMATIONS - CONSEILS
- Le diiode I2 est la seule espèce chimique colorée présente dans cette expérience. Il donne une teinte jaune-brun.
- Le diiode réagit avec les ions thiosulfates selon l’équation chimique : 1 I2 + 2 S2O32- → 2 I- + 1 S4O62- .
- Pour faciliter la réflexion, il est possible d’exprimer les quantités de matière en micromoles : 1 µmol = 10-6 mol.
- Au sujet du protocole : préparer les solutions dans des tubes à essais avant d’effecteur les mélanges. Les volumes
seront prélevés à l’aide d’une pipette jaugée.
DEMARCHE
A toi de mettre en ouvre le protocole proposé afin de répondre aux questions posées.
Pistes de réflexion
- En observant l’état final, on peut en déduire le réactif en défaut, appelé aussi réactif limitant, et le réactif en excès.
- Il est possible, pour chaque mélange, de calculer les quantités de matières initiales ni(I2) et ni(S2O32-) des réactifs.
- N’est-il pas possible de prévoir la couleur finale du mélange à partir de ces quantités initiales ?
1
/
1
100%