LA 3D SANS LUNETTES (CONSIGNES)

Observer 9
L
A
3D
SANS
L
UNETTES
(C
ONSIGNES
)
BUT
:
Modéliser des molécules en 3 dimensions à l'aide modèles moléculaires et d'un logiciel
Etudier et comprendre la géométrie des molécules. Aborder la représentation de Lewis
COMPETENCES : REA ANA COM AUT
Utiliser un logiciel dédié REA7
Formuler une hypothèse et proposer une méthode pour la valider
ANA1
Elaborer, choisir et utiliser un modèle adapté ANA2
Rendre compte de façon écrite
COM1
1. PRE-REQUIS
Structure électronique des atomes. Classification périodique simplifiée. Règle du duet et de l'octet. Formules brutes, développées et semi-
développées. Modèles moléculaires, couleur de représentation et nombre de liaisons développées par les atomes C, H, N et O.
Compléter la partie 1 puis la partie 2 du tableau1 ("Pré-requis") de la feuille bilan.
APPEL Appeler le professeur pour qu’il vérifie ou en cas de difficulté
Compléter la phrase du paragraphe 1 de la feuille bilan.
2. Formule développée de quelques molécules
Répondre à la question du paragraphe 2. de la feuille bilan
APPEL Appeler le professeur pour qu’il vérifie ou en cas de difficulté
Après vérification, compléter la ligne "Formule développée" du tableau 3 de la feuille bilan
3. Géométrie de molécules
3.1. Etude initiale
Le lien entre deux atomes représente la mise en commun de deux électrons (chaque atome en apporte un) formant ainsi un doublet liant appelée
liaison covalente. Répondre aux questions du paragraphe 3.1. de la feuille bilan
Réaliser les modèles moléculaires correspondants aux molécules du tableau. Observer.
Evaluer à l’aide d’un rapporteur l’angle entre les liaisons des quatre modèles moléculaires et compléter la ligne "angle évalué" du
tableau 3 de la feuille bilan.
3.2. Utilisation du logiciel Chemsketch
Réaliser la molécule de méthane :
mode Structure, dans la liste d’atomes (à droite) choisir C.
Dans la zone de traçage cliquer (il apparait CH4)
Dans le menu Tools choisir Add Explicit Hydrogen : la formule développée du méthane apparait.
Sélectionner l’icône (ou dans le menu Tools choisir 3D-optimisation)la formule développée tient alors compte de la géométrie
réelle de la molécule.
Choisir l’icône 3D Viewer (ce qui permet de basculer vers une représentation 3D) : le modèle moléculaire apparait.
Sélectionner l’icône (permet de voir le modèle éclaté).
Comparer au modèle moléculaire réalisé.
Choisir l’icône Angle puis cliquer successivement sur les trois atomes (H, C et H) : la valeur de l’angle de liaison s’affiche sur
l’écran.
Noter cette valeur dans la ligne "angle réel" du tableau 3 de la feuille bilan
Recommencer le même travail pour les molécules d’ammoniac, d’eau et de dioxyde de carbone.
Répondre à la question du paragraphe 3.2. de la feuille bilan
3.3. Justification de la géométrie
Il faut proposer une explication à la géométrie des molécules précédentes. Pour cela, on pourra se poser les questions suivantes :
Que remarque-ton concernant les valeurs des angles de liaison (à l’exception de CO
2
) ?
Quelles sont les molécules dont la géométrie supposée correspond à la géométrie réelle ?
Combien de doublets liants possèdent-elles ?
Dans les différentes molécules étudiées, combien d’électrons externes (y compris ceux de liaison) autour des atomes C, N, O ?
Combien cela représente-t-il de doublets ?
Tous les doublets sont-ils "identiques" ?
Quelle est la particularité de certains doublets ?
Parmi ces doublets combien sont des doublets liants pour chacun des atomes ?
D’après le nombre de doublets autour de chaque atome, quelle géométrie peut-on proposer ?
Si certains doublets sont des doublets liants, comment pourrait-on appeler les autres ?
Rédiger un paragraphe permettant de justifier la géométrie des molécules étudiées.
APPEL Appeler le professeur pour qu’il vérifie ou en cas de difficulté
4. Représentation de Lewis
La représentation suivante est la représentation de Lewis de la molécule d’eau :
Répondre aux questions du paragraphe 4 "Représentation de Lewis"
H — O — H

Observer
9
L
A
3D
SANS
L
UNETTES
(B
ILAN
)
1. PRE-REQUIS
Le nombre de liaisons possibles pour un atome ………………………….. au nombre d’électrons manquant pour satisfaire à la
règle du duet et de l’octet.
2. Formule développée de quelques molécules
2. Proposer des formules développées pour les molécules suivantes : méthane (CH
4
), ammoniac (NH
3
), eau (H
2
O) et dioxyde de
carbone (CO
2
).
3. Géométrie de molécules
3.1. Etude initiale ANA
3.1.1. Rayer le(s) terme(s) qui ne convien(nen)t pas :
Les doublets d’électrons sont : chargés positivement/neutres/chargés négativement.
Deux doublets d’électrons vont s’attirer/se repousser.
3.1.2. Dans le tableau 2, choisir (entourer) parmi les possibilités présentées, celles qui correspondent à une répulsion maximale
pour les doublets :
3.1.3. En déduire ce que devrait être la géométrie des quatre molécules du paragraphe 2 (compléter alors les lignes "géométrie
supposée" et "angle supposé" du tableau 3.
3.2. Utilisation du logiciel chemsketch
3.2.1. La géométrie supposée correspond-elle à la géométrie réelle ?
3.2.2. Compléter la dernière ligne du tableau 3 en utilisant les termes :
triangulaire ; pyramidale à base triangulaire ;
linéaire ; tétraédrique ; coudée.
3.3. Justification de la géométrie COM
Rédiger un paragraphe permettant de justifier la géométrie des molécules étudiées (écrire au dos si la place manque).

4. Représentation de Lewis
4.1. Dans la représentation de Lewis de la molécule d’eau ci-dessous, compléter la légende avec ce que représentent chacun des
symboles utilisés ?
4.2. Donner la représentation de Lewis pour chacune des autres molécules.
molécule
H
2
O NH
3
CH
4
CO
2
Représentation de
Lewis
Tableau 1
Partie 1
Partie 2
nom de l'atome symbole couleur du
modèle
nombre de
liaisons
possibles
numéro
atomique
Z
Structure
électronique
nombre
d'électrons
externes
nombre d'électrons
manquant pour satisfaire à la
règle du duet et de l’octet
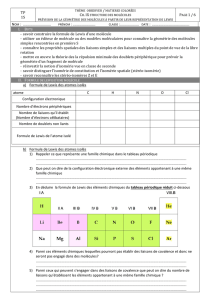
H 1 1
C 4 6
N 3 7
O 2 8
Tableau
2
2doublets 3 doublets 4 doublets
angle entre liaisons
180°
angle entre liaisons
90°
angle entre liaisons
90° et 180°
angle entre liaisons
120°
angle entre liaisons
109°
angle entre liaisons
90°
Tableau
3
molécule CH
4
NH
3
H
2
O CO
2
Formule
développée
géométrie supposée
(n° "modèle)"
angle supposé
angle évalué
(rapporteur)
angle réel
(chemsketch)
nom de la
géométrie
H — O — H
H — O — H
1
/
3
100%