Section 3.4 Le modèle de Bohr et de Bohr

Section 3.4 Le modèle de Bohr et de Bohr-Rutherford
Le comportement des atomes est une manifestation d’énergie. Chaque
élément possède son propre spectre lumineux. Un spectre est un arc-en-ciel
de diverses couleurs dont la combinaison crée la lumière blanche.
Niels Bohr tenta d’expliquer les spectres lumineux en mettant un modèle
planétaire de l’atome.
- Un électron circule, appelé une orbite, comme les planètes autour du
Soleil.
- Chaque électron qui suit une orbite possède une quantité d’énergie
déterminée.
- Plus un électron est éloigné, plus grande est son énergie.
- Les électrons ne peuvent pas exister entre les orbites, mais ils
peuvent se déplacer d’une orbite à l’autre (niveau d’énergie)
- Le nombre des électrons sur les premières 3 orbites (couches) est de
2, 8, 8.
- Les électrons sont plus stables près du noyau.
Quand les électrons sont stimulés par la chaleur, l’électricité ou la lumière,
cela leur donne une dose d’énergie supplémentaire. Ils sont projetés à un
niveau d’énergie supérieur; ils sont en état d’excitation.
Ils sont instables alors ils ont une tendance de revenir à leur état
fondamental. La couleur du spectre exprime la différence énergétique entre
les orbites.
Modèles Bohr

Modèles Bohr-Rutherford
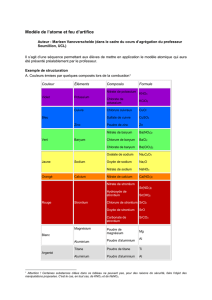
Page 93 no 2b, c et d
4a, b, c
5a, b, c
6a, b
1
/
2
100%