JMA Armstrong High School Sciences 9 Module Chimie Bohr

JMA Armstrong High School Sciences 9 Module Chimie
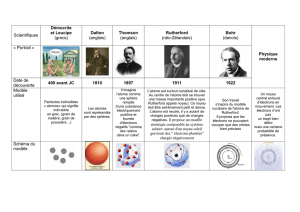
Bohr-Rutherford
Qui est Rutherford ?
Ernest Rutherford (un canadien de Montréal) a fait une expérience en bombardant une
feuille d’or de particules alpha. A partir de cet expérience, Rutherford formule un
nouveau modèle qui se nomme modèle nucléaire.
Modèle nucléaire:
Un atome renferme un minuscule noyau massif de charge positive, qui repousse
les particules alpha et contient des protons.
Le noyau est entouré d’espace vide dans lequel les électrons se déplacent
rapidement, laissant passer les particules alpha.
Qui est Bohr ?
Niels Bohr est un physicien danois qui a pris l’idée de Rutherford du modèle nucléaire
et est allé un peu plus loin en ajoutant que :
Un électron circule autour du noyau dans un mouvement circulaire, appelé
orbite, comme les planètes autour du soleil.
Chaque électron qui suit une orbite possède une quantité d’énergie déterminée.
Plus d’un électron est éloigné du noyau, plus grande est son énergie.
Les électrons ne peuvent exister entre les orbites, mais ils peuvent se déplacer
d’une orbite à l’autre.
Le nombre d’électrons sur les trois premières orbites est de 2, 8 et 8.
La stabilité des électrons est plus marquée près du noyau, là où leur niveau
d’énergie est plus faible.
Puisqu’on aimait certaines parties de chacune des théories, on a alors décidé de les
combiner.
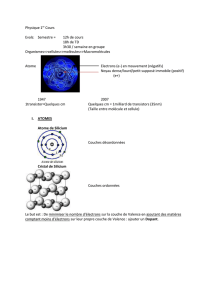
Modèle d’atome Bohr-Rutherford
Le cercle au centre représente le noyau où on écrit le nombre de protons et de
neutrons.
Les électrons sont de nouveau montrés dans leur gravitation autour du noyau sur
leur orbite.
1
/
1
100%