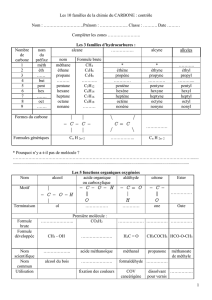
Révisions de chimie

NOM ………………………..Prénom : ……………………….Date :………………………
1
Contrôle récapitulatif de chimie
1. Le modèle de Bohr d’un atome et son symbole sont donnés ci-dessous
2. Dessiner les modèles de Lewis des atomes en utilisant les exemples
3. L’atome d’aluminium possède 13 électrons. L’ion aluminium s’écrit Al 3+.
Donner la définition d’un ion
…………………………………………………………………………………………………………………
………………………………………………………………………………………………………………...
4. Distinguer atomes, ions et molécules de la liste et les placer dans le tableau :
Fe ; CO2 ; H2O ; Zn ; Na+ ; OH - ; Cl - ; H ; C12H22O11 ; SO4 2 - ;
Atomes
Ions
Molécules
Carbone C
Z = 6
Chlore Cl
Z = 17
Oxygène O
Z = 8
Hydrogène H
Z = 1
Indiquer le signe et le nombre des particules
Electrons
Protons
Neutrons
Signe de la
particule
C
6
12

NOM ………………………..Prénom : ……………………….Date :………………………
2
5. Un composé chimique est dit organique lorsqu'il renferme au moins un atome de carbone lié, au
moins, à un atome d'hydrogène.
Identifier les composés organiques en cochant la case sous les modèles
Rouge
NH3
Rouge
6. Le gaz butane sert de combustible dans de nombreux appareils domestiques : cuisinières, appareils
de chauffage, etc…. Les briquets à gaz et les bouteilles de gaz destinées au campeurs contiennent
également du butane.
Compléter le tableau suivant :
Molécule
Formule
Atomes composant la
molécule
Masse molaire
moléculaire
Eau
H2O
……… …………………….
……………………………..
…………………………
………………………….
Dioxyde de
carbone
CO2
……………………………..
……………………………….
…………………………
………………………….
Données : masses molaires atomiques : M (C) = 12 g/mol ; M ( H ) = 1 g/mol ; M(O ) = 16 g/mol
7. Déterminer la concentration massique en g/L d’une solution de 117 mg de Chlorure de Sodium dans
2 Litres d’eau.
Blanc
Blanc
Noir

NOM ………………………..Prénom : ……………………….Date :………………………
3
8. La masse molaire du Chlorure de sodium Na Cl est de 58,5 g. Déterminer la concentration molaire
de la solution précédente.
9. Retrouver parmi ces modèles ceux de la molécule d’eau H2O, et du butane :
Donner la formule du butane et calculer sa masse molaire moléculaire :
10. Parmi ces équations chimiques, laquelle correspond à la combustion complète dans les meilleures
conditions du propane :
C3H8 + O2 CO2 + H2O
C3H8 + 6 O2 3 CO2 + H2O
C3H8 + 5 O2 3 CO2 + 4 H2O
Molécule de dioxyde de
carbone
Molécule de
…………………….
Molécule de
…………………..
.
Molécule de
dioxygène
Formule brute du butane :
Masse molaire moléculaire du butane :

NOM ………………………..Prénom : ……………………….Date :………………………
4
11. Sécurité et combustion
Le monoxyde de carbone fait de nombreuses victimes en hiver où on utilise des poêles à charbon et des
chauffes eau à gaz dans des pièces confinées : salle de bain, buanderies, …..
Le monoxyde de carbone (CO) qui pénètre dans les poumons se combine avec l’hémoglobine du sang. Il
bloque alors le transport de l’oxygène dans tout l’organisme, ce qui entraîne d’abord une perte de
connaissance (endormissement), puis la mort par asphyxie. Le monoxyde de carbone provient de la
combustion incomplète des combustibles comme le méthane CH4, le propane C3H8 et le butane C4H10. Les
chaudières à charbon provoquent très souvent ces combustions incomplètes…
Pour éviter l’intoxication due à ce dégagement de monoxyde de carbone, il faut
o Faire ramoner la cheminée.
o Vérifier le bon état des conduits et ouvertures d’aération.
o Aérer les pièces contenant les chauffes eau.
1. Pourquoi le monoxyde de carbone est-il dangereux pour l’homme ?
2. Citer une précaution à prendre pour éviter de tels accidents ?
12. Associer les pictogrammes (anciens mais encore d’actualité) avec leurs significations

NOM ………………………..Prénom : ……………………….Date :………………………
5
On donne :
M (C) = 12 g/mol M (H) = 1 g/mol M (Ca) = 40,1 g/mol
M (S) = 32 g/mol M (O) = 16 g/mol M (Fe) = 56 g/mol
M(Al) = 27 g/mol M( Mn)= 54,9 g/mol Volume molaire : 24 Litres
13. Calculer les masses molaires moléculaires des corps suivants :
(a) Le méthane CH4 (b) le sulfate de calcium Ca SO4
14. La densité d des corps gazeux par rapport à l’air se calcule à l’aide de la formule suivante :
d = M / 29 d n’a pas d’unité
M représente la masse molaire moléculaire du gaz concerné. 29 est la masse de 22,4 litre d’air en grammes.
Calculer les densités des gaz suivants :
dioxyde de carbone CO2 propane C3H8
Lors d’une fuite de propane, dans quelle partie de la pièce d’une habitation ce gaz va-t-il s’accumuler ?
Justifier.
 6
6
1
/
6
100%