Evaluation

PC* 14/15
Chapitre 1 : application du premier principe de la thermodynamique à la réaction chimique
1. Soit un objet solide (une bague or/diamant par exemple) de composition complètement
connue (masses mor d’or, md de diamant). On trouve dans les tables les capacités
calorifiques massiques (ci,w) et molaires (ci,m) des deux constituants.
1.1. Exprimer la capacité calorifique de la bague en fonction de ces grandeurs, et d’autres
grandeurs éventuellement utiles que l’on pourrait trouver dans les tables.
Le calcul donne 2,0 J.K-1
1.2. Calculer la quantité de chaleur reçue par la bague quand sa température passe de 15°C
à 25°C.
1.3. Même question quand elle passe de 37°C à 0°C.
2.1. Dans quels cas un apport de chaleur à un corps pur ne provoque-t-il pas d’élévation de
température ? (le corps ne subit pas de transformation chimique)
2.2. Quelle est la grandeur thermodynamique caractéristique de ce phénomène ? Avec
quelle(s) unité(s) s’exprime-t-elle ?
3.1. Quelle est la différence entre une transformation monotherme et une transformation
isotherme ?
3.2. À quelle condition une transformation monotherme est-elle aussi isotherme ?
3.3. À quelle condition une transformation monobare est-elle aussi isobare ?
4.1. Comment s’exprime la variation d’énergie interne pour un système immobile ?
4.2. Comment est définie la fonction enthalpie d’un système ?
4.3. Un système constitué de 1 mol de gaz parfait, initialement décrit par les paramètres p0,
V0, T0 subit différentes transformations élémentaires.
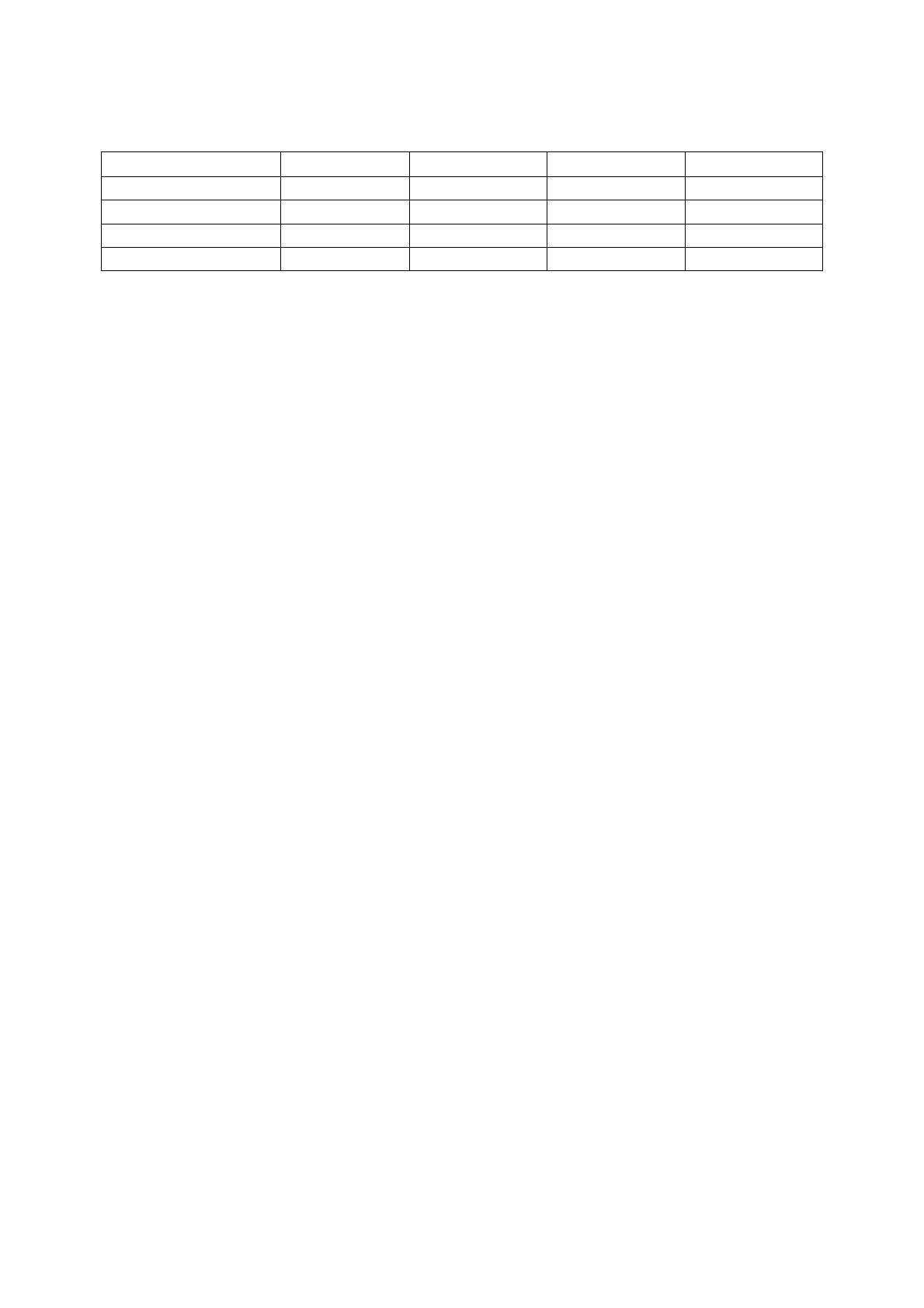
PC* 14/15
Compléter un maximum de cases du tableau suivant :
d W d Q d U d H
Isochore (V
0
)
Isobare (p
0
)
Isotherme (T
0
)
Adiabatique
5. On réalise un mélange de 1,0 mol d’un liquide A (50g/mol) avec 2,0 mol d’un liquide B
(75g/mol). Le volume du mélange homogène obtenu est 0,50 L. Exprimer puis calculer :
5.1. La fraction molaire de chacun des corps dans le mélange.
5.2. La concentration molaire de A dans le mélange.
5.3. La fraction massique de B dans le mélange.
5.4. La densité du mélange.
6. On considère la combustion du charbon (carbone graphite + divers débris minéraux) dans
l’air, donnant du dioxyde de carbone.
6.1. Ecrire l’équation de la réaction associée à cette transformation.
6.2. Quels sont les corps présents au cours de la transformation qui ne figurent pas dans la
réaction ?
6.3. Qu’appelle-t-on « conditions normales de température et de pression » ? L’air étant
considéré comme un gaz parfait, quel est son volume molaire dans les CNTP ?
7. On fait réagir du monoxyde d’azote NO sur du dioxygène avec production de dioxyde
d’azote.
7.1. Ecrire l’équation de la réaction relative à 1 mol de dioxygène.
7.2. On met en présence, à P et T données, 3,0 mol de monoxyde d’azote et 1,0 mol de
dioxygène. La réaction est supposée totale dans ces conditions.
a) Déterminer l’avancement de la réaction quand un des deux réactifs est entièrement
consommé.
b) Déterminer le taux de conversion (consommation, disparition…) de l’autre réactif à ce
moment.
1
/
2
100%











