Annales de chimie thematique 1 - Annales PACES Amiens - E

HTTP://ANNALES-PACES-AMIENS.E-MONSITE.COM
1
Annales de Chimie (UE 1) - Thématique
Table des matières
Présentation de la Chimie (UE1) ....................................................................................................................................... 2
Conseils pratiques et méthodologiques pour la chimie-physique.................................................................................... 3
Conseils pratiques et méthodologiques pour la chimie organique .................................................................................. 4
Chimie-Physique ............................................................................................................................................................... 5
Chimie Organique – I ...................................................................................................................................................... 17
Chimie Organique - II ...................................................................................................................................................... 27

HTTP://ANNALES-PACES-AMIENS.E-MONSITE.COM
2
Présentation de la Chimie (UE1)
La Chimie constitue, avec la Biochimie, le programme de l’UE1 (Atomes – Biomolécules – Génome –
Bioénergétique – Métabolisme).
Elle représente 20 questions sur 50, à l’épreuve d’UE1 d’une durée de 2 heures, soit 40 % de cette dernière.
Pour information, les coefficients de l’UE1 sont les suivants :
Indifférencié
Médecine/Kinésithérapie
Odontologie
Pharmacie
Sage-Femme
4
3,5
3,5
4
2,5
(Retrouvez plus d’informations concernant l’UE1 sur le site, en cliquant sur l’intitulé de la catégorie « UE1 » dans le menu du haut).
La Chimie se décompose en 3 grandes catégories :
- Chimie-Physique (7 questions) : étude détaillée des atomes et plus largement des bases physiques des
systèmes chimiques. C’est une matière très théorique, avec de nombreux principes et formules à appliquer. Il
est important de s’entraîner régulièrement aux exercices afin qu’ils deviennent un automatisme, notamment
la détermination de configurations électroniques d’atomes, d’enthalpies de réactions, etc. Avec de
l’entraînement et une bonne attention lors des cours magistraux, cette partie ne devrait pas trop poser de
problèmes, d’autant plus que ce sont les premiers cours enseignés.
- Chimie Organique I (6 à 7 questions, selon les années) : études de la configuration des molécules dans
l’espace et des grands principes des mécanismes réactionnels. Une grande partie du programme a déjà été
abordé au lycée (isomérie, acide/base…) et le reste est dans la continuité du programme et n’est pas difficile
à assimiler. Aller à l’ED correspondant peur s’avérer très profitable, car la majorité des molécules dans les
sujets du concours y ont déjà été présentées et étudiées.
- Chimie Organique II (6 à 7 questions, selon les années) : études des réactions chimiques les plus
courantes. Une connaissance solide du cours est absolument indispensable pour réussir cette partie, mais il
faut également faire preuve de réflexion et savoir établir des liens entre les diverses réactions vues. Pour
chaque réaction, il faut absolument connaître les réactifs mis en jeu, les produits, les étapes de la réaction et
leurs mécanismes détaillés. Pour cela, un entraînement avec les exercices est indispensable.

HTTP://ANNALES-PACES-AMIENS.E-MONSITE.COM
3
Conseils pratiques et méthodologiques pour la chimie-physique
La Chimie est dans la continuité du lycée. Il faut comprendre le cours, les principes, les règles, les
démonstrations. Savoir retrouver des équations de dosage, dessiner des molécules, maîtriser les formules
chimiques de base, etc ... Tout ça se travaille via exercices, tutorat, TD. L'entraînement joue donc une part
prépondérante de la réussite de cette matière.
Bien évidemment, il faut connaître les formules et les définitions sur le bout des doigts. Cela semble
évident, et effectivement, elles sont relativement simples à assimiler. Mais c’est tout de même la première
étape pour réussir les exercices.
La réussite en chimie-physique consiste en la capacité d’exécution fiable et rapide d’un nombre fini
d’exercices-types. Ainsi, savoir son cours « par cœur » est nécessaire mais ne suffit pas. Il faut le sur-
maîtriser pour savoir l’appliquer à travers les exercices. La présence en ED est primordiale car on y retrouve
les exercices qui ont le plus de chances d’être retrouvés au concours.
Il est primordial de bien travailler sur sa fiabilité en calcul mental (la calculatrice est interdite le jour du
concours). La partie chimie-physique n’étant pas très complexe par rapport au reste des cours, la
sélectivité est moindre et se fait en grande partie lors du calcul (donc gare aux fautes d’étourderies).
Attention donc aux unités, aux manipulations d’exposants, aux divisions… Lors des ED et de vos
entraînements, obligez-vous à exécuter tous les calculs mentalement : seul l’entraînement et l’habitude
permettent de progresser.
D’une certaine manière, en chimie-physique, la sélection se fait sur la rapidité de l’exécution des exercices.
En effet, puisque c’est une matière relativement simple, avec un entraînement rigoureux et régulier, vous
gagnerez facilement du temps sur cette partie. Ainsi, vous pourrez consacrer plus de temps au reste de
l’épreuve, plus difficile.
La Chimie est l’une des rares matières où il peut être intéressant de chercher des éclaircissements en
dehors du cours du professeur sur certains points qui peuvent être obscurs. Evidemment, c’est toujours le
cours du professeur qui fait foi lors du concours, mais la recherche d’informations annexes sur internet,
de schémas etc, ne seront pas une perte de temps, à la seule condition qu’ils vous aident à comprendre.
Cependant, le livre « Cours de Chimie-Physique » de Paul Arnaud est une véritable mine d’informations et
peut être très utile si vous avez des problèmes de compréhension notamment en ce qui concerne
l’atomistique, la thermodynamique, les réactions acido-basiques…

HTTP://ANNALES-PACES-AMIENS.E-MONSITE.COM
4
Conseils pratiques et méthodologiques pour la chimie organique
Assistez à tous les cours et ED, sans faute (en particulier la Chimie Organique II). Il est très difficile de
comprendre parfaitement toutes les subtilités des réactions chez soi. C’est lors des cours que les
professeurs prendront le temps de bien expliquer les réactions unes par une, en insistant sur le
déroulement des mécanismes et les étapes délicates à comprendre.
Encore plus qu’en chimie-physique, il faut surinvestir dans la compréhension du cours. Ne faire
qu’apprendre aveuglément les réactions sans comprendre leur mécanisme vous sera préjudiciable lorsque
vous serez face à un exercice d’application. Sans oublier qu’une réaction comprise s’apprend bien plus
aisément. Vous devez donc analyser, pour chaque réaction présentée, les mécanismes rencontrés en les
décomposant et en effectuant une analyse rigoureuse.
Niveau matériel, inutile d’acheter « LA BOIIIIIITE ! ». Même en tant que pharma, elle ne s’avère absolument
pas indispensable.

HTTP://ANNALES-PACES-AMIENS.E-MONSITE.COM
5
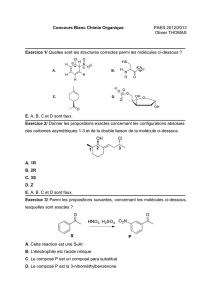
Chimie-Physique
Décembre 2011
1) Spectre de raie
Données : énergie d’ionisation de l’atome d’hydrogène : E1 = 13,6 eV
constante de Planck : h=6.10-34 J.s
célérité de la lumière dans le vide : c=3.108 m.s-1
charge d’un électron : e=1,6.10-19 C
Indiquer quelles sont les propositions exactes.
A. Le passage de l’électron de l’hydrogène du niveau n=4 au niveau n=2 est associé à une énergie de -2,55 eV.
B. La longueur d’onde associée à cette transition est de 441 nm.
C. Cette transition correspond à un phénomène d’absorption.
D. L’énergie sur le niveau 2 est de -3,40 eV.
E. L’énergie sur le niveau 3 est de -5,12 eV.
2) Orbitales atomiques – structures électroniques.
Indiquer quelles sont les propositions exactes.
A. A l’état fondamental un atome est toujours à son niveau énergétique le plus bas.
B. Pour des orbitales atomiques ayant la même énergie, les électrons se répartissent avec un nombre minimum
de spins parallèles.
C. Les orbitales de l’atome 8O se remplissent de la façon suivante : 1s²2s²2p4.
D. La configuration électronique de Ti²+ (Z=22) est 1s²2s²2p63s²3p64s².
E. Les nombres quantiques n, 1 et m définissent un seul électron.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%