LV312 Génétique et Biologie Moléculaire I

LV312 Génétique et Biologie Moléculaire I
1ère session-26 mai 2009
CORRIGE
Sujet de Génétique- Durée conseillée : 1h- Sans document ni calculatrice- Les téléphones
portables doivent être éteints. Vos réponses doivent être concises mais néanmoins
justifiées.
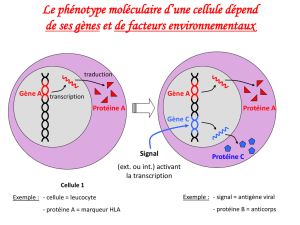
Le syndrome de Noonan (NS) est une maladie autosomique dominante, avec de nombreux
effets pléiotropes (problèmes cardiaques, défauts du squelette, anomalies sanguines…). Pour
certains individus, la mutation responsable de cette maladie est une mutation de type faux-
sens dans le gène PTN11, qui code pour une protéine intervenant dans une voie de
transduction de signal impliquant le récepteur transmembranaire EGFR, la petite protéine G
Ras et la MAP kinase ERK. Dans les conditions normales, cette voie est activée par la
fixation d’un ligand au récepteur EGFR. Il existe plusieurs protéines permettant de réguler
l’activité de cette voie, telle que la protéine Argos, qui est un régulateur négatif. La protéine
PTN11 est également une protéine régulatrice de cette voie, mais on ne sait pas s’il s’agit d’un
régulateur positif ou négatif (Figure 1). Cette voie est conservée chez tous les métazoaires, et
intervient dans de nombreux processus cellulaires (prolifération, différenciation…). Afin de
déterminer la fonction précise de la protéine PTN11 dans la voie (régulateur positif ou
négatif) et de comprendre pourquoi certains allèles mutants de PTN11 sont responsables de
l’apparition de NS, des lignées transgéniques de Drosophile permettant de modéliser cette
maladie ont été générées, en utilisant l’homologue Drosophile de PTN11, appelé corkscrew
(csw).
Deux allèles mutants du gène csw contenant des mutations identifiées chez certains malades
ont été générés : l’allèle cswA72S (mutation d’une A en S à la position 72) et l’allèle cswN308D
(mutation d’une N en D à la position 308). Ces allèles ont été clonés dans un vecteur
permettant de faire de la transgenèse, sous contrôle d’un promoteur minimal et de séquences
UAS (transgènes UAS-cswA72S et UAS-cswN308D). A titre de contrôle, l’allèle sauvage de csw a
été également cloné de la même façon (transgène UAS- cswWT). Ces trois transgènes ont été
utilisés pour générer des lignées transgéniques de drosophile.
Q1. Expliquez le principe de la transgenèse à l’élément P chez la drosophile (15 lignes
maximum et schéma).
-Elément P : transposon qui peut s’insérer au hasard dans le génome de la drosophile, donc
utilisé comme vecteur de transgenèse
-Pour s’insérer, P doit avoir des pieds fonctionnels, et il faut la production de transposase
-Pour la transgenèse, utilisation de deux plasmides fournissant ces deux éléments (pieds et
transposase) séparément: le premier plasmide a des pieds fonctionnels, un marqueur de
transgenèse (ex : gène white+) et le transgène souhaité; le second plasmide a des pieds
défectueux et contient le gène qui code pour la transposase ; ce plasmide ne peut pas
s’intégrer dans le génome des embryons injectés et sera donc perdu au cours des divisions

cellulaires, ce qui permet d’avoir des lignées transgéniques stables car dépourvues de
transposase.
-Co-injection des 2 plasmides au pole postérieur (= localisation des futures cellules de la
lignée germinale) d’embryons mutés dans le gène white ; récupération d’adultes G0 issus des
embryons injectés (ils ont tous les yeux blancs) ; croisements individuels de ces adultes G0
avec des adultes mutés dans le gène white ; les adultes G0 qui n’ont pas intégré le transgène
dans leur lignée germinale ont 100% de descendants à yeux blancs ; les adultes G0 qui ont
intégré le transgène dans une cellule de leur lignée germinale ont une lignée germinale
mosaïque, ce qui se traduit par une descendance G1 constituée d’individus à yeux blancs (non
transgéniques) et d’individus à yeux colorés (transgéniques). Ces derniers sont récupérés et
utilisés pour établir des lignées transgéniques.
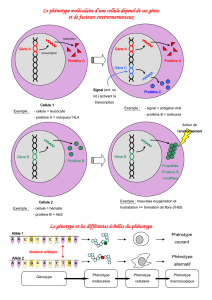
Pour chaque transgène, une lignée homozygote contenant le transgène inséré sur le
chromosome II a été obtenue. Ces trois lignées ont été croisées avec une lignée pilote
contenant le transgène Ptub-Gal4 à l’état homozygote sur le chromosome II (Ptub: promoteur
du gène tubuline, qui s’exprime de manière ubiquitaire tout au long du développement). Des
embryons issus de ces croisements ont été récoltés, leurs protéines extraites et mises à migrer
sur gel. A la fin de la migration, le gel a été transféré sur membrane et celle-ci a été incubée
avec un anticorps spécifique de la protéine Corkscrew (expérience de « western blot »)
(Figure 2).
Q2. Expliquez le principe du système UAS-Gal4 (5 lignes maximum et schéma).
-Système UAS-Gal4= système bipartite permettant l’expression d’un gène de manière tissu
spécifique, stade de développement spécifique…
-Gal4=activateur transcriptionnel de levure qui se fixe sur des séquences spécifiques appelées
UAS
- La première lignée utilisée contient le transgène à exprimer : celui-ci est cloné sous contrôle
d’un promoteur minimal et de séquences UAS ; la seconde lignée contient le transgène pilote :
celui-ci contient le gène Gal4 sous contrôle d’un promoteur particulier (ici, promoteur
ubiquitaire tubuline)
-Les descendants issus du croisement entre ces deux lignées expriment de manière ubiquitaire
(grâce au pilote tubuline::Gal4) le transgène étudié.
Q3. Interprétez le résultat de la figure 2.
Les trois transgènes csw utilisés permettent bien, grâce à Gal4, l’expression, en à peu près la
même quantité, de la protéine Csw sauvage ou mutée (pour chaque lignée, comparer la piste
avec et sans pilote Gal4). Les deux mutations testées n’ont pas d’effet sur la stabilité de la
protéine. De plus, la surexpression de cette protéine (sauvage ou mutée) n’entraine pas de
létalité (ou alors pas une létalité totale) dans les stades précoces du développement
(embryogenèse) puisqu’on obtient des embryons.
Ces trois lignées ont ensuite été croisées avec une autre lignée pilote : celle-ci contient le
transgène Ptub-Gal4 à l’état hétérozygote inséré sur le chromosome III, face à un

chromosome balanceur TM3, Sb1 (l’allèle Sb1 confère à l’état hétérozygote un phénotype
adulte de soies courtes et épaisses, noté [Sb], et une létalité à l’état homozygote). Les adultes
issus de chacun de ces croisements ont été dénombrés. Les résultats sont présentés dans le
tableau 1.
Q4. Interprétez le résultat de ces croisements en écrivant les génotypes et phénotypes des
parents et des descendants. Que peut-on en conclure sur les allèles mutants UAS-cswA72S
et UAS-cswN308D ?
Descendance théorique attendue s’il n’y a pas de létalité d’une catégorie: 50% [Sb], qui ne
sur-expriment pas Csw, 50% [Sb+], qui sur-expriment Csw.
C’est ce qu’on observe avec cswWT et cswN308D, ces deux protéines sur-exprimées
ubiquitairement n’induisent donc pas de létalité. Pas contre, on n’observe aucun [Sb+] avec
cswA72S. La sur-expression ubiquitaire de cette protéine mutée est donc létale
Les adultes [Sb+] issus du croisement avec la lignée UAS-cswN308D présentent dans 100% des
cas des anomalies au niveau du plan d’organisation de l’aile (Figure 3C, présence de nervures
surnuméraires), alors que ce n’est pas le cas des adultes [Sb+] issus du croisement avec la
lignée UAS-cswWT (Figure 3B), dont l’aile est identique à celle de la souche de référence
(Figure 3A). Par ailleurs, le phénotype des individus 3C ressemble au phénotype d’une lignée
exprimant une forme mutante constitutivement active du récepteur EGFR (= récepteur
capable de transduire un signal même en l’absence de son ligand) (Figure 3E). Ce phénotype
est à comparer également avec celui d’individus portant une mutation perte de fonction
partielle du gène csw (Figure 3D).

Q5. D’après ces résultats, répondez aux questions suivantes :
(1) Que pouvez-vous conclure sur le rôle de la voie de transduction EGFR dans le
développement des nervures de l’aile ?
Comparaison 3A/3E: l’activation constitutive de la voie de transduction impliquant le
récepteur EGFR induit des nervures surnuméraires. Cette voie de transduction régule donc
positivement la formation des nervures.
(2) Ces résultats vous permettent-ils de préciser la fonction de la protéine régulatrice
Csw ?
Comparaison 3E/3D: un mutant perte de fonction pour csw présente le phénotype inverse
d’une activation constitutive de la voie, c'est-à-dire des nervures incomplètes. Ce résultat
suggère que la fonction de la protéine Csw est de réguler positivement la voie de transduction
EGFR/ERK.
(3) Comment interprétez-vous l’effet de la mutation cswN308D sur la fonction de la
protéine Csw ?
Comparaison 3C/3E : la sur-expression de la protéine CswN308D a le même effet que le
récepteur constitutif EGFR : l’effet de la mutation cswN308D est donc d’hyper-activer la voie
de transduction (allèle gain-de-fonction). Ce phénotype n’est pas observé quand on sur-
exprime la protéine Csw sauvage (3B).
Afin de confirmer ces hypothèses, des individus portant à la fois le transgène UAS-cswN308D,
le transgène Ptub-Gal4, ainsi qu’un allèle mutant M dans un gène de la voie de transduction
étudiée (Figure 1), ont été générés par croisement, et leurs ailes ont été observées. Leur
phénotype de nervures surnuméraires a été comparé avec celui des individus portant
seulement le transgène UAS-cswN308D et le transgène Ptub-Gal4. Le tableau 2 résume les
résultats obtenus avec les différents allèles M utilisés (+++ : aggravation du phénotype des
individus UAS-cswN308D, Ptub-Gal4 ; --- : suppression du phénotype des individus UAS-
cswN308D, Ptub-Gal4).
Q6. Interprétez ces résultats. Confirment-ils les résultats de la question Q5?
On réalise ici des expériences d’interactions génétiques.
Le phénotype cswN308D est supprimé par deux allèles perte de fonction d’acteurs de la voie
(EGFR et Ras). A l’inverse, le phénotype cswN308D est augmenté par un allèle perte de
fonction du régulateur négatif Argos. Ces résultats montrent donc que l’allèle cswN308D induit
une hyper-activation de la voie, et joue un rôle opposé à celui du régulateur négatif Argos.
Sujet écrit d’après Oishi et al. (2006), Human Molecular Genetics 15, 543-553

ligand
EGFR
Ras
ERK
Gènes cibles
EGFR
Argos
-
+
+
PTN11
(Csw) + ou -?
Figure 1: Schéma simplifié de la voie de transduction du signal EGFR/ERK.
+: régulation positive; -: régulation négative
Figure 2: Western blot de protéines d’embryons avec un anticorps dirigé contre
la protéine Csw. Le génotype des embryons est indiqué au dessus de chaque piste.
WT: embryons sauvages
 6
6
1
/
6
100%