II.1) Les Différents Modèles de l`Atome

II.1) Les Différents Modèles de l’Atome
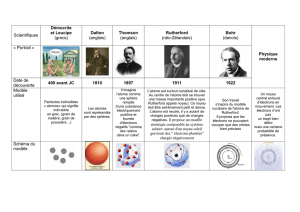
A) Premier modèle : La brique élémentaire (Grec, Ve siècle av J.-C.)
Atome = Grain indivisible de matière (origine éthymologique)
= Brique élémentaire de toute matière
+ Notion de 4 éléments : Eau / Terre / Air / Feu
Qui réagissent parfois entre eux…
Cette notion d’éléments demeure jusqu’à la fin du XVIIIe siècle lorsqu’on commence à décomposer ces éléments en
substances plus élémentaires, et surtout avec l’arrivée de la pile électrique et de l’électrolyse, qui sépare
l’élément “eau” en gaz et en solide… Il faut un autre modèle… Les éléments chimiques tels qu’ils sont connus
aujourd’hui (Hydrogène H, Helium He, …)
B) Second modèle : Découverte de l’électron (Thomson, 1897, prix Nobel 1906)
Modèle de Thomson : L’atome est décomposable en électrons, de charge
négative, plongés dans une “soupe” de charges positives pour équilibrer
celles des électrons.
En fait, Thomson vient de découvrir l’existence de charges négatives qu’il a
réussi à “arracher” à la matière et à dévier par un champ
électromagnétique (tube cathodique). Il propose donc ce modèle de
répartition de ces charges négatives dans les atomes par intuition…
C) Troisième modèle : Modèle Planétaire (Rutherford, 1909)
Modèle de Rutherford : Le noyau est en fait de très petite taille par rapport à la
taille de l’atome qui est essentiellement vide.
Expérience de Rutherford : Il bombarde une feuille très fine d’or avec des
noyaux d’Helium (particule α) et constate que ceux-ci traversent en étant
quasiment pas déviés. La matière est donc VIDE !!! Le noyau est donc de
petite extension.
Mais il ne parle pas trop de la répartition des électrons autour du noyau…
D) Quatrième modèle : Modèle Planétaire Avec Quantification des Niveaux d’énergie (Bohr, 1913)
Modèle de Bohr : Il s’agit en fait d’un complément du modèle de
Rutherford. Il précise que les électrons ne peuvent se trouver
QUE SUR DES ORBITES DE RAYON QUANTIFIES (voir le
cours, cela correspond à des énergies bien définies).
Expérience démonstrative : un atome excité n’émet de la lumière
que suivant certaines longueurs d’onde correspondant aux
changement de niveaux d’énergie des électrons dans cet atome.
(voir cours)
Atomes
indivisibles
“Soupe” de
charges +
Electrons
Noyau
localisé
Electrons
Noyau
localisé
Electrons sur des
orbites imposées
1
/
1
100%