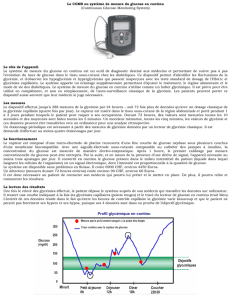
Pratique du contrôle glycémique en réanimation et charge

Réanimation (2009) 18, 538—543
MISE AU POINT
Pratique du contrôle glycémique en réanimation
et charge de travail infirmier
Practical aspects and nursing workload of glucose control
in intensive care
J.-C. Preisera,∗, J. Perreauxa, P. Modanèsea, T. Sottiauxb, P. Devosc
aService de soins intensifs généraux, CHU de Liège, domaine du Sart-Tilman, bâtiment B35, 4000 Liège, Belgique
bService de soins intensifs, clinique Notre-Dame-de-Grâce, 212, chaussée de Nivelles, 6041 Gosselies, Belgique
cService de soins intensifs, CHC clinique Saint-Joseph, 75, rue de Hesbaye, 4000 Liège, Belgique
Rec¸u le 13 mai 2009 ; accepté le 13 juin 2009
Disponible sur Internet le 7 juillet 2009
MOTS CLÉS
Insuline ;
Glycémie ;
Hypoglycémie ;
Charge de travail ;
Étude multicentrique
Résumé Après la publication des effets spectaculaires du contrôle strict de la glycémie par
insulinothérapie intensive en 2001, les limites acceptées de glycémie ont été revues à la baisse.
Les aspects pratiques de cette politique sont revus dans cet article, ainsi que le retentissement
sur l’incidence des hypoglycémies et la charge de travail infirmier. En pratique, ces éléments,
comme l’absence de confirmation de la validité externe de l’étude de 2001, ont conduit la
majorité des réanimateurs à adopter une cible glycémique intermédiaire.
© 2009 Société de réanimation de langue franc¸aise. Publié par Elsevier Masson SAS. Tous droits
réservés.
KEYWORDS
Insulin;
Blood glucose;
Hypoglycaemia;
Nursing workload;
Multicentre study
Summary Following the publication of the spectacular effects of tight glucose control by
intensive insulin therapy in 2001, the glycemic targets have been lowered. The practical aspects
of this policy are reviewed here. The effects of tight glucose control on the risks of hypogly-
caemia and on the nursing workload are discussed as well. These latter issues, and the lack of
confirmation of the external validity of the landmark 2001 study, lead to the adoption of an
intermediate glucose target by the majority of intensivists.
© 2009 Société de réanimation de langue franc¸aise. Published by Elsevier Masson SAS. All rights
reserved.
L’hyperglycémie aiguë est fréquemment rencontrée chez
les patients de soins intensifs et résulte des changements
∗Auteur correspondant.
Adresse e-mail : [email protected]
(J.-C. Preiser).
hormonaux et humoraux qui accompagnent la réaction dite
«de stress »[1]. La pratique courante jusqu’il y a peu,
encore d’usage dans un tiers des soins intensifs européens
à ce jour [2], visait au maintien de la glycémie entre 8,8
(160 mg/dl) et 11,1 mmol/l (200 mg/dl), limite historique
qui reposait vraisemblablement sur la notion de seuil de
réabsorption tubulaire rénal. Le relatif manque d’intérêt
1624-0693/$ – see front matter © 2009 Société de réanimation de langue franc¸aise. Publié par Elsevier Masson SAS. Tous droits réservés.
doi:10.1016/j.reaurg.2009.06.009

Pratique du contrôle glycémique en réanimation et charge de travail infirmier 539
pour la glycémie comme marqueur de la sévérité de
l’affection est par ailleurs reflété par son absence dans le
calcul des scores de gravité habituels.
L’attention a été attirée vers un contrôle strict de la gly-
cémie chez le patient de soins intensifs par la publication
en 2001 d’une étude réalisée par Van den Berghe et al. [3].
En résumé, cette étude avait comparé un traitement insuli-
nique conventionnel ayant pour objectif une glycémie entre
10 et 11,1 mmol/l (180—200 mg/dl) à un traitement intensif
visant une glycémie entre 4,4 et 6,1 mmol/l (80—110 mg/dl).
Les résultats ont impressionné toute la communauté des
réanimateurs : le groupe «insulinothérapie intensive »avait
une mortalité intrahospitalière réduite de 34 % et une série
de complications a été fortement limitée (−46 % pour les
bactériémies, −41 % pour les insuffisances rénales aiguës
nécessitant une hémofiltration, −44 % pour les polyneuro-
pathies des soins intensifs, −50 % pour le nombre moyen
de transfusions érythrocytaires). À l’inverse des attentes
importantes suscitées par ces résultats, ces données spec-
taculaires n’ont pu être confirmées par d’autres [4—9]. Pire
même, dans la plus vaste de ces études prospectives [9],la
mortalité à 90 jours était augmentée dans le groupe insu-
linothérapie intensive par rapport au groupe témoin. Trois
méta-analyses récentes [10—12] ont sans surprise montré
que le traitement par insulinothérapie intensive ne permet
pas de réduire la mortalité hospitalière en soins intensifs.
Dès lors, la cible glycémique «optimale »est loin d’être défi-
nie à l’heure actuelle et pourrait d’ailleurs différer selon le
type de patient ou de pathologie. Un autre sujet de débat
important concerne les raisons de la discordance entre
l’étude princeps [3] et les suivantes. Parmi les hypothèses
d’explication, une meilleure «performance »dans l’atteinte
de la cible glycémique liée à une pratique et une motivation
plus importantes des équipes infirmières à Louvain, où fut
réalisée la première étude qu’ailleurs a été évoquée. Dans
cet article, nous allons aborder les aspects pratiques actuels
du contrôle glycémique qui pourraient affecter la qualité
de la performance : les problèmes courants, la réalité du
terrain.
Aspects pratiques
Les aspects pratiques revêtent bien entendu une impor-
tance fondamentale dans la qualité du contrôle glycémique
et comportent plusieurs aspects que nous aborderons
successivement : la mesure de la glycémie (site de pré-
lèvement, appareil de mesure et interférences possibles),
l’insulinothérapie (voie d’administration, algorithmes, sys-
tème d’infusion) et les améliorations possibles pour le
futur (automatisation de l’infusion d’insuline, monitorage
continu).
Mesure de la glycémie
Site de prélèvement
Le site de prélèvement sanguin représente une source
potentielle de divergence entre valeurs de glycémie. Le
niveau de divergence varie en fonction de l’état du patient,
notamment du degré de vasoconstriction périphérique. De
plus, l’utilisation de lecteurs portables conc¸us pour la
mesure de la glycémie sur sang capillaire de patients ambu-
latoires est une source d’imprécision chez le patient de
soins intensifs et nécessite une validation par rapport à la
méthode de référence (mesure par méthode enzymatique
à l’hexokinase (HK) sur sang artériel ou veineux). L’impact
de ces imprécisions sur la pratique clinique a été quantifié
par plusieurs équipes [13—18], qui ont comparé les valeurs
obtenues par le même appareil de mesure sur des prélè-
vements de différents sites et ont évalué l’impact clinique
des différences par rapport au «gold standard ». De manière
concordante, ces études ont montré que ces différences
entre valeurs mesurées étaient suffisamment importantes
pour modifier la décision clinique (débit d’insuline). Dès
lors, pour un contrôle fiable de la glycémie, le prélèvement
artériel ou veineux est préférable au prélèvement capillaire
[19].
Appareil de mesure
Les lecteurs portables utilisés fréquemment pour le contrôle
glycémique en réanimation ont en fait été conc¸us pour
le contrôle de la glycémie sur sang capillaire, principale-
ment chez des patients diabétiques ambulatoires. La mesure
de la glycémie par lecteur portable se base sur les tech-
niques enzymatiques utilisant la glucose oxydase (GO) ou
la glucose deshydrogénase (GD), alors que la technique
de référence utilise l’HK. La GO est l’enzyme le plus
ancien et est moins stable que la GD, nécessitant donc
plus de précaution de prélèvement et de conservation. De
plus, les lecteurs portables peuvent constituer une source
d’imprécision à d’autres niveaux : la glycémie est mesu-
rée sur un échantillon de sang total par les appareils de
laboratoire, et c’est la concentration plasmatique qui est
mesurée par la plupart des lecteurs portables et les ana-
lyseurs de gaz sanguin. Or, les valeurs peuvent différer de
manière significative et ce, d’autant plus que l’hématocrite
est élevé. Une recommandation récente de l’American Dia-
betes Association (ADA) et de l’International Federation of
Clinical Chemistry and Laboratory Medicine (IFCC) suggère
d’appliquer un facteur de correction de 0,9 (c’est-à-dire
de multiplier une valeur plasmatique par 0,9 pour obtenir
la valeur correspondante sur sang total) pour la conversion
[20].
Par ailleurs, la précision, la fiabilité et la reproductibi-
lité des mesures de la concentration sanguine de glucose
sont bien évidemment cruciales. De manière générale,
les valeurs mesurées par les lecteurs de glycémie por-
tables présentent régulièrement une déviation de plus
de 10 % par rapport aux valeurs de laboratoire. Néan-
moins, dans le contexte des soins intensifs, quelques études
[13,17,18,21,22] ont montré que la précision des lecteurs
de glycémie portables est insuffisante notamment en cas
d’hypothermie ou de choc sévère.
Interférences possibles
Sur le plan théorique, de nombreuses interférences phy-
siques et chimiques peuvent influencer la mesure de la
glycémie par lecteur de glycémie portable, selon le type
d’enzyme utilisé. Chez le patient de soins intensifs, les
variations de pression partielle en oxygène (PO2), de
l’hématocrite et de la température constituent les facteurs
les plus fréquemment rencontrés.

540 J.-C. Preiser et al.
Schéma d’insuline
Utilité des algorithmes
L’utilisation de schémas d’insuline individuels, prescrits par
un médecin pour l’administration sous-cutanée ou intravei-
neuse en bolus ou en perfusion continue, a été comparée
à l’utilisation de schémas systématiques [17]. Sans équi-
voque, l’utilisation d’algorithme I/S permet d’atteindre plus
rapidement et de se maintenir plus longtemps dans une
cible glycémique préétablie, ainsi que de limiter l’incidence
d’hypoglycémies. Une revue récente [23] fait le point
complet sur les schémas utilisés et montre à quel point
les consignes de débit d’insuline peuvent différer pour une
glycémie donnée. De toute évidence, l’introduction d’un
schéma d’insulinothérapie doit être accompagnée d’un pro-
gramme éducatif de formation du personnel, indispensable à
l’amélioration de la performance. Sans aucun doute, le bon
sens, l’expérience et le sens clinique du personnel soignant
est tout aussi fondamental pour adapter au mieux un schéma
préétabli et très souvent imparfait. Néanmoins, ces qualités
de terrain indispensables sont évidemment difficiles à quan-
tifier. La seule manière de mesurer ces éléments serait en
fait de mesurer la déviation de la pratique par rapport à un
schéma préétabli.
Type d’algorithme
Le choix d’un type performant d’algorithme est évidem-
ment fondamental. Globalement, il existe deux types de
protocoles : «sliding scale »ou «dynamic scale »: le pre-
mier attribue à une valeur de glycémie un débit d’insuline,
alors que le second tient compte de la glycémie précédente,
du délai entre les mesures et du débit précédent d’insuline
pour déterminer le nouveau débit. Clairement, la seconde
stratégie permet d’améliorer fortement la performance, par
rapport à la première [24].
Automatisation [25]
Le lecteur pourra trouver une discussion complète de ce
sujet dans l’article de Kalfon [25], dans ce même numéro
de Réanimation.
Problèmes courants
Suite à la publication de la première étude de Louvain [3],
de nombreuses équipes ont instauré un contrôle strict de
la glycémie en utilisant la même cible. Rapidement, de
nombreux problèmes sont survenus, limitant de la sorte
l’applicabilité de cette stratégie thérapeutique. Plusieurs
enquêtes auprès d’équipes de nursing [26,27] ont ainsi docu-
menté les obstacles à la mise en application du contrôle
strict de la glycémie : crainte de l’hypoglycémie, charge
de travail, désintérêt de l’équipe médicale, ressources
techniques insuffisantes, absence d’algorithme adapté. Si
une partie de ces problèmes est sans doute de nature et
d’importance variables selon les institutions et les uni-
tés, les risques liés à l’hypoglycémie et la charge de
travail infirmier sont certainement des problèmes plus
généraux et méritent dès lors une attention particu-
lière.
Hypoglycémie
Le «prix à payer »pour le contrôle glycémique strict par
insulinothérapie intensive est sans surprise un accroissement
de l’incidence des hypoglycémies. De manière remarquable-
ment cohérente, les études prospectives [3—9] ont rapporté
une multiplication par un facteur5à6del’incidence
des hypoglycémies dans un groupe traité intensivement
par rapport au groupe «témoin »[10,11]. Par ailleurs, la
survenue d’une hypoglycémie, indépendamment d’une insu-
linothérapie intensive, est connue de longue date comme
un facteur de gravité. À l’inverse, l’hypoglycémie surve-
nant en cours d’insulinothérapie intensive était considérée
comme un simple incident de parcours ou aléa thérapeu-
tique transitoire. Des données récentes sont venues semer
le doute à ce sujet : Krinsley et Grover [28] ont mis en
évidence sur un échantillon de 102 patients qui ont pré-
senté une hypoglycémie, appariés 1 : 3 avec des cas-témoins
de gravité équivalente, une surmortalité dans le groupe
hypoglycémique. La régression logistique multivariée a per-
mis d’identifier la survenue d’une hypoglycémie en cours
d’insulinothérapie intensive comme facteur prédictif de
mortalité (accroissement du risque relatif d’un facteur 2,3).
En ce qui concerne les études prospectives, la mortalité des
patients avec hypoglycémie est de deux à trois fois plus éle-
vée que chez les patients sans hypoglycémie [29]. Il ne s’agit
pas évidemment ici d’affirmer une relation de causalité
entre survenue d’une hypoglycémie sous insulinothérapie
intensive et risque de décès, mais simplement de consta-
ter l’association, qui justifie une investigation détaillée.
A priori, si l’hypoglycémie était délétère, ce serait vraisem-
blablement par le biais d’une neuroglycopénie. Des données
intéressantes ont été obtenues chez des patients cérébro-
lésés et ont démontré que le rapport lactate—pyruvate du
liquide céphalorachidien, témoin d’un déficit énergétique
cérébral s’élevait déjà lorsque la glycémie était inférieure
à 80 mg/dl (4,7 mmol/l) [30]. Cet effet est probablement
expliqué par le fait que la glycorachie (concentration en
glucose du liquide céphalorachidien) est systématiquement
inférieure à la glycémie [31] et que le glucose est l’unique
substrat énergétique utilisable par un cerveau lésé. Une
meilleure compréhension des effets de l’hypoglycémie chez
le patient de soins intensifs est indispensable avant d’en
affirmer l’innocuité, surtout chez le patient comateux ou
sédaté par définition asymptomatique. Les progrès que l’on
peut attendre dans le domaine du contrôle glycémique
devront viser à dépister plus précocement les hypoglycémies
et à en réduire l’incidence.
Charge de travail infirmier
En pratique, la gestion du contrôle glycémique est confiée
entièrement au nursing, tant en ce qui concerne la mesure
des glycémies que l’adaptation du débit d’insuline. La pro-
cédure de contrôle glycémique strict a donc inévitablement
un impact sur la charge de travail infirmier [19].
Nous avons utilisé les données de l’étude Glucontrol [8]
pour évaluer l’impact mesurable du contrôle glycémique
strict [32]. En pratique, nous avons comparé entre les
groupes «insulinothérapie intensive »et «insulinothérapie
conventionnelle »(visant une glycémie entre 7,8 et

Pratique du contrôle glycémique en réanimation et charge de travail infirmier 541
10,0 mmol/l), le nombre de mesures de glycémie requis, la
fréquence de modifications du débit d’insuline et de la fré-
quence de préparations de nouvelles seringues d’insuline.
Chacun de ces actes a été chronométré, à savoir le temps
nécessaire à une mesure de glycémie depuis le prélèvement
via le cathéter artériel en place, l’analyse de l’échantillon
par un analyseur de gaz sanguins disponible dans l’unité ou
par un lecteur de glycémie portable (Accu-Chek Inform®
Roche Diagnostics), jusqu’à la retranscription du résultat.
Nous avons également chronométré le temps nécessaire à
la préparation d’une seringue d’insuline, sa mise en place
sur le dispositif nécessaire à son administration (seringue
électrique) ainsi que le temps nécessaire à régler le débit
d’insuline. Chacune de ces mesures a été réalisée 50 fois
d’affilée, afin de refléter au mieux la réalité de terrain
(y compris l’attente de fin de calibration des appareils
de mesure, le problème d’échantillonnage, les problèmes
techniques divers), et les moyennes (±déviation standard)
de ces mesures ont été calculées. Enfin, ces mesures
moyennes ont été multipliées par le nombre de mesures de
glycémie et de changement de débit d’insuline enregistrés
dans la base de données de Glucontrol.
Mesure de la glycémie
En utilisant l’analyseur de gaz sanguins sur échantillon
sanguin prélevé par un cathéter artériel, nous avons tout
d’abord observé que les temps ont varié en fonction
de l’accessibilité de l’appareil (autre collègue utilisant
l’appareil au même moment), d’une calibration de la
machine ou d’un autre problème technique. Nous avons
ainsi pu déterminer que le temps moyen était de cinq
minutes et 39 secondes (plus ou moins deux minutes et
dix secondes) par mesure. Sachant que pour le groupe
«insulinothérapie intensive »de Glucontrol, une médiane de
sept mesures par jour était réalisée (versus cinq par jour
dans le groupe «insulinothérapie conventionnelle »), nous
avons ainsi observé une différence de plus de 11 minutes
et 18 secondes par jour, ou une multiplication par un fac-
teur 1,4 du temps infirmier dans le groupe «insulinothérapie
intensive »par rapport au groupe témoin.
En utilisant un lecteur portable pour mesurer la glycé-
mie sur échantillon artériel, nous avons observé que les
temps ont varié en fonction de la disponibilité de l’appareil.
En moyenne, le temps nécessaire à la mesure était de
quatre minutes et 36 secondes (plus ou moins une minute et
cinq secondes). La différence quotidienne entre le groupe
«insulinothérapie intensive »et «insulinothérapie conven-
tionnelle »atteignait ainsi neuf minutes et 12 secondes, ou
une multiplication par un facteur 1,4 du temps infirmier.
Préparation et adaptation du débit d’insuline
L’insulinothérapie intraveineuse nécessite d’abord la pré-
paration d’une seringue d’insuline par la dilution d’une
solution concentrée d’insuline humaine (100 UI/ml, Actra-
pid Penfill®, Novo-Nordisk) dans 20 ml de sérum salé. Ces
temps peuvent varier en fonction de la proximité du maté-
riel, de la dextérité et de l’expérience de chaque membre
du personnel. En moyenne, le temps nécessaire à la pré-
paration d’une seringue d’insuline de 20 ml (contenant une
unité par millilitre) est d’une minute et trois secondes.
Nous avons ensuite utilisé les débits médians (fourchette
interquartile) d’insuline des deux groupes de l’étude Glu-
Tableau 1 Comparaison des temps nécessaires à la réali-
sation du contrôle glycémique dans l’étude Glucontrol.
Groupe
«insulinothérapie
intensive »
Groupe
«insulinothérapie
conventionnelle »
Temps moyen pour
réaliser une
mesure
glycémique avec
un analyseur de
gaz sanguin +
préparation d’une
seringue d’insuline
41 min 39 sec 28 min 40 sec
Temps moyen pour
réaliser une
mesure
glycémique avec
un lecteur de
glycémie +
préparation d’une
seringue d’insuline
34 min 18 sec 23 min 25 sec
control, à savoir 1,8 (1,0—2,9) unités par heure pour le
groupe «insulinothérapie intensive »et 0,4 (0,0—1,4) unité
par heure pour le groupe «insulinothérapie convention-
nelle »pour comparer la charge de travail. Pour le groupe
«insulinothérapie intensive », la seringue est à remplacer
environ toutes les 13 heures, alors que pour le groupe
«insulinothérapie conventionnelle », elle est à remplacer
toutes les 60 heures, en tout cas en théorie (en pratique,
la durée de validité d’une seringue d’insuline ne dépasse
pas 24 heures). Ainsi, le temps consacré à la préparation
des seringues d’insuline est de deux minutes et six secondes
par jour pour le groupe «insulinothérapie intensive »et
de 25 secondes par jour pour le groupe «insulinothérapie
conventionnelle ».
Temps infirmier total nécessaire à l’insulinothérapie
intensive
Le temps total nécessaire à l’insulinothérapie intensive peut
ainsi être déduit de la somme des composants détaillés
ci-dessus. En additionnant le temps consacré à la mesure
de la glycémie et à l’administration d’insuline, et en les
adaptant aux valeurs obtenues lors de l’étude Glucontrol,
il apparaît entre les groupes «insulinothérapie intensive »
et «insulinothérapie conventionnelle »une différence de
12 minutes et 59 secondes si les glycémies sont mesurées par
analyseur de gaz sanguins et de dix minutes et 53 secondes
si un lecteur portable est utilisé (Tableau 1). De plus,
une réflexion sur l’adaptation de l’algorithme nécessite un
temps supplémentaire. Ces chiffres sont certainement à
intégrer lors du calcul des moyens humains et matériels à
prévoir lors de la mise en œuvre de l’insulinothérapie inten-
sive.
Réalité de terrain et conclusion
Après la publication des résultats de l’étude de Van den
Berghe et al. en 2001 [3], l’attitude des cliniciens a été émi-

542 J.-C. Preiser et al.
nemment variable, allant de l’application stricte des limites
de glycémie utilisées à Louvain (4,4—6,1 mmol/l), à une
attitude plus conservatrice (insulinothérapie intraveineuse
instaurée en cas de glycémie supérieure à 10,0 mmol/l)
en passant par une attitude intermédiaire (maintien de la
glycémie en dessous de7à9mmol/l). Cette dispersion des
attitudes est reflétée par les résultats de plusieurs enquêtes
de pratique [2,33,34]. Nous avons notamment rapporté
récemment les résultats d’une enquête réalisée en Belgique
en 2007, à l’initiative du collège de la fonction soins inten-
sifs du service public fédéral «Santé Publique »(taux de
réponse : 52 sur 120, soit 43 %). Dans cette enquête, même
si 96 % des répondeurs étaient au courant des travaux de Van
den Berghe et al. [3], les limites basses et hautes de gly-
cémie considérées comme tolérables pour la majorité des
répondeurs étaient 2,8 mmol/l et 7,8 mmol/l, respective-
ment. Il est possible que les résultats de Nice-Sugar publiés
récemment [9] influenceront les pratiques et les recomman-
dations [10]. Au vu de la surmortalité à 90 jours observée
dans le groupe «insulinothérapie intensive », l’utilisation
d’une cible intermédiaire [29,35] paraît raisonnable.
Conflits d’intérêts
Aucun.
Références
[1] Dungan K, Braithwaite S, Preiser JC. Stress hyperglycaemia.
Lancet 2009;373:1798—807.
[2] Devos P, Ledoux D, Preiser JC. Current practice of glycaemia
control in European intensive care units (ICUS). Intensive Care
Med 2005;31:S203 [abstract].
[3] Van den Berghe G, Wouters P, Weekers F, Verwaest C,
Bruyninckx F, Schetz M, et al. Intensive insulin therapy in the
critically ill patients. N Engl J Med 2001;345:1359—67.
[4] Van den Berghe G, Wilmer A, Hermans G, Meersseman W,
Wouters PJ, Milants I, et al. Intensive insulin therapy in the
medical ICU. N Engl J Med 2006;354:449—61.
[5] Brunkhorst F, Engel C, Bloos F, Meier-Hellmann A, Ragaller
M, Weiler N, et al. Intensive insulin therapy and penta-
sarch resuscitation in severe sepsis. N Engl J Med 2008;358:
125—39.
[6] De La Rosa GD, Donado JH, Restrepo AH, Quintero AM,
Gonzalez LG, Saldarriaga NE. Strict glycaemic control in
patients hospitalised in a mixed medical and surgical inten-
sive care unit: a randomised clinical trial. Crit Care 2008;12:
R120.
[7] Arabi YM, Dabbagh OC, Tamim HM, Al-Shimemeri AA, Memish
ZA, Haddad SH, et al. Intensive versus conventional insu-
lin therapy: a randomized controlled trial in medical and
surgical critically ill patients. Crit Care Med 2008;36:
3190—7.
[8] Devos P, Preiser JC, Melot C, on behalf of the Glucontrol stee-
ring committee. Impact of tight glucose control by intensive
insulin therapy on ICU mortality and the rate of hypoglycae-
mia: final results of the Glucontrol study. Intensive Care Med
2007;33:S189 [abstract].
[9] Finfer S, Chittock DR, Su SY, Blair D, Fosterer D, Dhingra V, et
al. Intensive versus conventional glucose control in critically ill
patients. N Engl J Med 2009;360:1283—97.
[10] Wiener RS, Wiener DC, Larson RJ. Benefits and risks of tight
glucose control in critically ill adults: a meta-analysis. JAMA
2008;300:933—44.
[11] Griesdale DE, de Souza RJ, van Dam RM, Heyland DK, Cook
DJ, Malhotra A, et al. Intensive insulin therapy and mortality
among critically ill patients: a meta-analysis including NICE-
SUGAR study data. CMAJ 2009;180:821—7.
[12] Marik P, Preiser JC. Towards understanding Tight Glycemic
Control in the ICU: a systematic review. Submitted.
[13] Desachy A, Vuagnat AC, Ghazali AD, Baudin OT, Longuet OH,
Calvat SN, et al. Accuracy of bedside glucometry in critically
ill patients: influence of clinical characteristics and perfusion
index. Mayo Clin Proc 2008;83:400—5.
[14] Finkielman JD, Oyen LJ, Afessa B. Agreement between bed-
side blood and plasma glucose measurement in the ICU setting.
Chest 2005;127:1749—51.
[15] Maser RE, Butler MA, DeCherney GS. Use of arterial blood
with bedside glucose reflectance meters in an intensive
care unit: are they accurate? Crit Care Med 1994;22:
595—9.
[16] Kanji S, Singh A, Tierney M, Meggison H, McIntyre L, Hebert
PC. Standardization of intravenous insulin therapy improves
the efficiency and safety of blood glucose control in critically
ill adutls. Intensive Care Med 2004;30:804—10.
[17] Kulkarni A, Saxena M, Price G, O’Leary MJ, Jacques T, Myburgh
JA. Analysis of blood glucose measurements using capillary
and arterial blood samples in intensive care patients. Intensive
Care Med 2005;31:142—5.
[18] Kost GJ, Vu HT, Lee JH, Bourgeois P, Kiechle FL, Martin C,
et al. Multicenter study of oxygen-insensitive handheld glu-
cose point-of-care testing in critical care/hospital/ambulatory
patients in the United States and Canada. Crit Care Med
1998;26:581—90.
[19] Ichai C, Léone M, Veber B, Cariou A, Barnoud D, Annane D, et al.
Glycemic control in intensive care unit and during anaesthesia.
Ann Fr Anesth Reanim 2009;28:410—5.
[20] Dungan K, Chapman J, Braithwaite SS, Buse J. Glucose mea-
surement: confounding issues in setting targets for inpatient
management. Diabetes Care 2007;30:403—9.
[21] Critchell CD, Savarese V, Callahan A, Aboud C, Jabbour S,
Marik P. Accuracy of bedside capillary blood glucose measu-
rements in critically ill patients. Intensive Care Med 2007;33:
2079—84.
[22] Louis RF, Tang Z, Sutton DV, Lee JH, Kost GJ. Point-of-care
glucose testing: effects of critical care variables, influence of
reference instruments, and a molecular glucose meter design.
Arch Pathol Lab Med 2000;124:257—66.
[23] Wilson M, Weinreb J, Hoo GW. Intensive insulin therapy
in critical care: a review of 12 protocols. Diabetes Care
2007;30:1005—11.
[24] Meijering S, Corstjens AM, Tulleken JE, Meertens JH, Zijlstra
JG, Ligtenberg JJ. Towards a feasible algorithm for tight gly-
caemic control in critically ill patients: a systematic review of
the literature. Crit Care 2006;10:R19.
[25] Kalfon P. Automatisation du contrôle strict de la glycémie en
réanimation. Reanimation 2009;16.
[26] Aragon D. Evaluation of nursing work effort and perceptions
about blood glucose testing in tight glycemic control. Am J
Crit Care 2006;15:370—7.
[27] Cook CB, Abad V, Kongable G, Hanseon Y, McMahon D. The sta-
tus of glucose control in US intensive care units. Crit Care Med
2008;36:A68 [abstract].
[28] Krinsley JS, Grover A. Severe hypoglycemia in critically
ill patients: risk factors and outcomes. Crit Care Med
2007;35:2262—7.
[29] Preiser JC. Nice-Sugar: the end of sweet dreams. Crit Care
2009;13:143.
[30] Oddo M, Schmidt JM, Carrera E, Badjatia N, Connolly ES, Pres-
ciutti M, et al. Impact of tight glycemic control on cerebral
glucose metabolism after severe brain injury: a microdialysis
study. Crit Care Med 2008;36:3233—8.
 6
6
1
/
6
100%