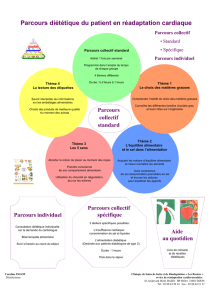
15. Chaleurs de reactions chimiques

B.T.S. T.P.L. \ Mécanique et Thermodynamique \ Chaleurs de réactions chimiques
1
T.P
. N°
15
C
HALEURS DE
R
EACTIONS
C
HIMIQUES
Le but du T.P. est de déterminer les chaleurs molaires de réactions chimiques de dissolution d’un sel
par la méthode des mélanges.
Matériel
• 1 centrale d’acquisition H.P. + 1 Pt 100 4 fils
• 1 agitateur magnétique
• 1 calorimètre Pierron avec un vase en verre
• du chlorure d’ammonium NH
4
Cl et du thiosulfate de sodium pentahydraté Na
2
S
2
O
3
,5H
2
O
• 1 balance
I. Problématique
On désire déterminer la chaleur molaire de réaction de dissolution d’un sel, le thiosulfate de sodium
pentahydraté Na
2
S
2
O
3
, 5 H
2
O dans l’eau Q
diss
(Na
2
S
2
O
3
). Pour cela on va utiliser la méthode des
mélanges qui consiste à introduire le sel dans un calorimètre contenant de l’eau.
Mais avant cela, nous devons déterminer la capacité thermique du vase calorimétrique C. Cette
détermination se fera en dissolvant un sel dont on connaît la chaleur molaire de dissolution, le
chlorure d’ammonium, Q
diss
(NH
4
Cl) = 16,0 kJ.mol
-1
.
Écrire les équations chimiques de dissolution du chlorure d’ammonium et du thiosulfate de
sodium.
Les réactions de dissolution du chlorure d’ammonium et du thiosulfate de sodium sont
endothermiques. C’est-à-dire qu’elles nécessitent de la chaleur pour avoir lieu.
Où est prise cette chaleur ? En déduire l’évolution de la température de l’eau.
Exprimer la chaleur Q
1
perdue par l’eau présente initialement dans le calorimètre et par le vase
du calorimètre.
Exprimer la chaleur Q
2
reçue par le sel et lui permettant de se dissoudre dans l’eau en fonction
de la masse de sel m
sel
, de la masse molaire du sel M
sel
et de la chaleur de dissolution
Q
diss
(NH
4
Cl).

B.T.S. T.P.L. \ Mécanique et Thermodynamique \ Chaleurs de réactions chimiques
2
En considérant le calorimètre purement adiabatique (aucune fuite thermique) et en négligeant
l’apport d’énergie thermique du à la masse de sel introduit, quelle est la relation entre Q
1
et Q
2
?
Compléter le schéma suivant :
En déduire le bilan thermique suivant :
( )( )
sel
eau eau i f diss
sel
m
m .c C Q
M
+ θ −θ =
Exprimer C en fonction des autres grandeurs.
Exprimer Q
diss
en fonction des autres grandeurs.
II. Mesures
La masse d’eau m
eau
sera pesée directement dans le vase calorimétrique en verre.
La température sera mesurée avec la Pt 100 reliée à la centrale d’acquisition H.P. pilotée par un P.C..
On donne la capacité thermique massique de l’eau : c
eau
= 4,18 J.g
-1
.K
-1
.
On donne les masses molaires des sels : M
NH4Cl
= 53,49 g.mol
-1
et M
Na2S2O3,5H2O
= 248,18 g.mol
-1
et
celle de l’eau M
eau
= 18 g.mol
-1
.
• Mettre environ 300g d’eau dans le vase calorimétrique.
Calculer la masse de de chlorure d’ammonium pour obtenir une dilution à 100 : 1 mole de soluté
(sel) pour 100 moles de solvant (eau distillée).
• Effectuer l’acquisition de la température au cours du temps lors de la dissolution.
Les deux températures θ
i
et θ
f
doivent clairement apparaitre sur la courbe θ = f(t).
• Afin de déterminer avec précision la masse de sel dissout, vérifier s’il ne reste pas un peu de sel
dans le récipient utilisé. Si c’est le cas déterminer la masse de sel restant afin d’en déduire la
véritable masse de sel introduit dans le calorimètre.
• Exporter ces données dans Synchronie.
• Recommencer l’expérience en dissolvant cette fois-ci du thiosulfate de sodium.
La seule différence est le taux de dilution : effectuer une dilution à 300 au lieu de 100.
III. Exploitation
• Exploiter la première série de données afin de déterminer la capacité thermique C du vase.
Donner les résultats avec trois chiffres significatifs et son unité.
• Exploiter la seconde série de données afin de déterminer la chaleur de dissolution du thiosulfate
de sodium Q
diss
(Na
2
S
2
O
3
).
Comparer votre valeur à celle donnée par la littérature scientifique,
Q
diss
(Na
2
S
2
O
3
) = 40,0 kJ.mol
-1
en calculant l’écart relatif en pourcentage.
Chaleur : Q1 = Q2
--------------------------
------------------------------------------
1
/
2
100%




![Cr déjeuner des représentants 4-10-201[...]](http://s1.studylibfr.com/store/data/000257029_1-c85e56035f3e42dcb2b5096af800ff1f-300x300.png)



