sénescence rénale, sénescence cellulaire et leur rôle en

FLAMMARION
MÉDECINE
-
SCIENCES
—
ACTUALITÉS
NÉPHROLOGIQUES
2001
(www.medecine-flammarion.com)
SÉNESCENCE RÉNALE, SÉNESCENCE CELLULAIRE
ET LEUR RÔLE
EN NÉPHROLOGIE ET TRANSPLANTATION
par
P. F. HALLORAN et A. MELK*
Chez l’homme, la fonction rénale diminue régulièrement avec l’âge à partir
d’environ 30 ans. Bien qu’elle soit variable à l’échelon individuel, cette diminution
est facilement mesurée et globalement prédictible à l’échelon de la population. Les
principales caractéristiques de cette diminution de fonction rénale due à l’âge sont
une baisse du débit de filtration glomérulaire, une élévation des résistances vas-
culaires rénales et une élévation de la fraction filtrée. Ces modifications traduisent
probablement un vieillissement rénal considéré comme « normal ». L’exclusion
d’un certain nombre de néphrons survient d’une manière régulière sans protéinurie
ni perte de sel, ce qui suggère plutôt un mécanisme régulé qu’un mécanisme patho-
logique. Lorsqu’existent en plus, une hypertension artérielle ou une insuffisance
cardiaque, ces modifications sont accélérées. De surcroît, l’incidence de l’insuffi-
sance rénale chronique terminale augmente avec l’âge, passant d’environ 10 par
million d’habitants avant l’âge de 20 ans à 1000 par million d’habitants après
65 ans. Néanmoins, une fonction rénale normale peut être observée à 70 voire
80 ans [1]. De plus, l’âge du donneur représente le principal déterminant de perte
de fonction après transplantation rénale. Cet article propose une revue des avancées
récentes en matière de biologie cellulaire, de vieillissement cellulaire ainsi que
leurs implications sur le vieillissement physiologique du rein.
Définitions
Il importe que la terminologie relative au vieillissement soit précise. L’âge est
le temps écoulé depuis la naissance. Le terme « sénescence rénale » définit un phé-
notype structurel et fonctionnel propre aux reins âgés. Les « sénescences cellulaire
* Division of Nephrology and Immunology, University of Alberta, Edmonton, Canada.
sénescence rénale, sénescence cellulaire

250
P
.
F
.
HALLORAN
ET
A
.
MELK
et réplicative » ont trait au phénotype
in vitro
des cellules somatiques qui ont
atteint la limite de leur faculté de réplication, un état qui peut ou non exister pour
ces mêmes cellules
in vivo
. Les études
in vitro
qui utilisent des cellules âgées,
c’est-à-dire provenant d’un sujet âgé, doivent être distinguées des études qui uti-
lisent des cellules sénescentes, c’est-à-dire des cellules qui ont développé
in vitro
un phénotype de sénescence. Des études
in vivo
peuvent d’ailleurs chercher à iden-
tifier ces cellules sénescentes.
Le phénotype de sénescence rénale
Chez l’homme, la sénescence rénale est caractérisée par une diminution de la
masse rénale, particulièrement aux dépens du cortex, du nombre de cellules [2],
une augmentation de l’hétérogénéité et l’apparition d’anomalies focales. Les prin-
cipales caractéristiques histologiques de la sénescence rénale sont des anomalies
vasculaires (hyalinose et épaississement fibreux de l’intima des artères, hyalinose
des artérioles), une sclérose diffuse des glomérules avec duplication des capsules
de Bowman, une atrophie tubulaire focale avec présence de lipofuschine, une
fibrose interstitielle et des foyers d’inflammation. Les relations entre ces différen-
tes lésions sont encore peu claires : sclérose glomérulaire, atrophie tubulaire et
fibrose interstitielles sont-elles primitives ou secondaires ? En revanche, la sénes-
cence rénale n’est pas associée à une protéinurie significative, une hématurie,
l’apparition d’une insuffisance rénale chronique terminale, une sclérose focale ou
un infarctus lié à une occlusion artérielle. Les glomérules scléreux du cortex super-
ficiel semblent avoir leur artériole afférente occlue par un épaississement de
l’intima tandis que les glomérules scléreux du cortex profond semblent avoir des
shunts entre artériole afférente et efférente. Dans les deux cas, les modifications
artériolaires pourraient être secondaires aux modifications glomérulaires et vice
versa.
Les manisfestations du vieillissement du rein dans une population humaine non
sélectionnée peuvent être décrites grâce à des formules telles que celle de Cock-
croft-Gault [3] ou celle du MDRD [4]. Ces formules décrivent un phénotype fonc-
tionnel de sénescence rénale non sélectif qui reflète certes les modifications
spécifiquement liées à l’âge mais aussi celles qui sont liées aux maladies associées
à l’âge comme l’hypertension artérielle ou l’insuffisance cardiaque. La Baltimore
Longitudinal Study on Aging décrit un phénotype plus sélectif puisque en sont
exclues toutes les maladies rénales, l’hypertension artérielle et l’insuffisance car-
diaque. Dans ce cas, la diminution moyenne du débit de filtration glomérulaire est
de, 0,75 ml/min/an. Un tiers des sujets de 80 ans ont encore une fonction rénale
normale [1]. Ainsi, les caractéristiques phénotypiques de la sénescence rénale
pourraient être dues à des facteurs n’ayant rien à voir avec le temps, comme le
stress ou le niveau de pression artérielle.
Quel est le mécanisme expliquant la perte de néphrons en l’absence de protéi-
nurie, d’hématurie, de perte de sel et d’autres marqueurs de maladie rénale ? Bien
que les sujets âgés aient une diminution de leurs facultés d’excrétion et/ou de réten-
tion d’eau et de sel, ils parviennent néanmoins à maintenir un état stable malgré
une baisse d’environ 50 p. 100 de leur débit de filtration glomérulaire. Nous pen-
sons qu’il doit exister d’abord un détecteur puis un interrupteur. Le détecteur éva-
lue la performance globale d’un néphron donné et décide de l’exclure en mettant
en jeu l’interrupteur. L’interrupteur quant à lui est probablement d’origine vascu-

SÉNESCENCE
RÉNALE
,
SÉNESCENCE
CELLULAIRE
251
laire. Un détecteur de performance du néphron situé dans l’appareil juxta-glomé-
rulaire pourrait ainsi moduler le calibre de l’artériole glomérulaire afférente.
L’appareil juxta-glomérulaire est un détecteur bien connu de la quantité de sel :
une quantité élevée de sel au contact de la macula densa provoque une vasocons-
triction qui « exclut » le néphron. Ceci empêcherait les néphrons malades de géné-
rer une perte sodée et donc de perturber la balance sodée. Ce mécanisme pourrait
aussi ne pas être régulé et refléter les seules modifications histologiques constatées
sur les petits vaisseaux.
Bien que l’incidence de l’insuffisance rénale chronique terminale soit de 50 à
100 fois supérieure chez les sujets de plus de 65 ans que chez ceux de moins de
20 ans [5], l’insuffisance rénale chronique terminale n’en demeure pas moins une
affection rare chez les sujets âgés (environ 1 cas pour 1000). Ainsi, le vieillissement
physiologique ne conduit-il pas systématiquement à l’insuffisance rénale terminale.
Dans le domaine de la transplantation, les receveurs d’organes provenant de
donneurs âgés, en particulier d’origine cadavérique, ont une moins bonne fonction
que ceux qui ont bénéficié d’un donneur plus jeune. D’ailleurs, le facteur ayant
l’impact négatif le plus important est bien l’âge du donneur [6]. Les reins de don-
neurs âgés ont un risque accru de reprise retardée de fonction, de rejet aigu, de
néphropathie chronique d’allogreffe, de diminution significative du débit de filtra-
tion glomérulaire ainsi qu’un risque augmenté de perte du greffon qu’elle soit pré-
coce ou tardive. Certaines de ces caractéristiques sont à l’évidence dues au
contexte de la mort de ces donneurs âgés, comme l’incidence accrue d’accidents
vasculaires cérébraux hémorragiques et d’hypertension artérielle. Mais l’âge du
donneur demeure un facteur très péjoratif même lorsque ces facteurs confondants
sont pris en compte [7]. Cet effet est moins important chez les donneurs vivants,
ce qui peut refléter bien sûr l’effet de sélection mais aussi l’absence de stress lié
au processus global de prélèvement des reins de cadavre.
À partir de quand, l’âge du donneur intervient-il en transplantation rénale ?
L’effet âge du donneur combine probablement des facteurs liés à la date de la mort
cérébrale et des facteurs qui interviennent après la transplantation. L’effet majeur
est observé sur le taux de reprise retardée de fonction et le débit de filtration glo-
mérulaire à 6 mois. De plus, la perte de fonction due à l’âge intervient sur le rein
transplanté comme sur le rein natif, cette perte pouvant être bien sûr accélérée par
d’autres facteurs comme l’hypertension artérielle.
Bases moléculaires de la sénescence
Le phénotype de sénescence peut être la conséquence d’une perte de cellules,
l’émergence et la persistance de cellules anormales et d’altérations biochimiques
de la matrice extracellulaire. Au contraire, la perte globale de cellules pourrait
témoigner d’une possibilité limitée de remplacement plutôt que d’un excès de
perte. Les théories de la sénescence insistent sur l’accumulation de lésions dans
les cellules après la mitose et l’épuisement des capacités de réplication des cellules
ayant un potentiel mitotique. Les radicaux libres générés par la respiration cellu-
laire provoquent des altérations des lipides, des protéines et de l’ADN [8]. L’ins-
tabilité génomique peut entraîner des modifications de l’ADN mitochondrial et la
perte de l’ADN télomérique.
Les études portant sur les aspects génétiques de la sénescence suggèrent un rôle
prépondérant des facteurs environnementaux [9]. Dans certains types cellulaires, la

252
P
.
F
.
HALLORAN
ET
A
.
MELK
sénescence
in vitro
provoque la perte de la faculté des cellules à développer une
réponse apoptotique, ce qui suggère que l’accumulation de cellules sénescentes pour-
rait contribuer au vieillissement en modifiant la fonction globale des tissus. L’inter-
dépendance des différents organes grâce aux facteurs humoraux pourrait contribuer
au vieillissement, par exemple grâce à la perte de certaines fonctions hormonales.
Plusieurs auteurs ont postulé que le phénotype de sénescence était le reflet d’un pro-
gramme génétique tout comme celui du développement.
Nous nous focaliserons sur quelques théories dérivées de la situation
in vitro
et
qui semblent avoir un impact
in vivo
chez l’homme. Nous insisterons également
sur les difficultés à comparer les situations humaine et murine.
Raccourcissement des télomères
Les cellules somatiques humaines en culture
in vitro
ne peuvent subir qu’un
nombre limité de divisions [10]. Ce nombre de cycles est appelé le nombre de
Hayflick. Il est plus bas pour les cellules de sujets âgés. Ainsi, les cellules soma-
tiques humaines
in vitro
possèdent un mécanisme comptant le nombre de fois où
elles se sont divisées, une sorte d’« horloge mitotique ». Elles s’arrêtent définiti-
vement lorsque ce nombre est atteint et présentent alors un état de « sénescence
réplicative ». Au contraire, les cellules de souris en culture ont des limites définies
par leur susceptibilité aux agressions et non par une horloge mitotique.
Dans les cellules humaines, le raccourcissement des télomères est une phase
critique de la sénescence réplicative. En 1973, Olovnikov proposa la théorie des
télomères, à savoir que les cellules somatiques sont limitées car elles ne peuvent
pas complètement répliquer leurs télomères [11] (fig. 1). Les télomères sont des
séquences d’ADN simple (TTAGGG) répétées à la fin des chromosomes et qui
raccourcissent dans les cellules normales en division. Les télomères empêchent les
terminaisons des chromosomes d’être confondues avec des cassures d’ADN et ont
probablement d’autres fonctions comme la protection contre la dégradation enzy-
matique, la recombinaison et les fusions interchromosomiques. Les extrémités des
télomères peuvent être répliquées grâce à une enzyme, la télomérase, une protéine
ribonucléique exprimée dans les populations cellulaires germinales ou immortali-
sées qui maintiennent constante la longueur des télomères. Les fibroblastes
humains en culture n’ont pas de télomérase et ont donc un raccourcissement de
leurs télomères à chaque cycle cellulaire. Ils développent donc une sénescence
réplicative lorsque la longueur des télomères devient critique. L’expérience déter-
minante fut la démonstration que la transfection de la télomérase dans une popu-
lations de cellules humaines en culture augmentait la durée de vie de ces cellules
et leur capacité de réplication [12], permettant ainsi de dépasser la limite du nom-
bre de Hayflick.
L’ADN télomérique diminue d’environ 100 paires de bases dans les cellules
somatiques normales à chaque division. La perte des télomères déclenche une réac-
tion analogue à celle induite par les cassures d’ADN, qui résulte en un état cellu-
laire organisé, le phénotype de sénescence (M1 sur la fig. 1). Les cellules qui
continuent à se diviser en réponse à des stimuli anormaux développent une insta-
bilité génomique considérable ou crise (M2). Les cellules germinales ou immor-
talisées comme la plupart des lignées de cellules cancéreuses possèdent des
mécanismes qui soit activent la télomérase, soit au contraire, préservent indéfini-

SÉNESCENCE
RÉNALE
,
SÉNESCENCE
CELLULAIRE
253
ment la longueur des télomères en dépit des divisions cellulaires protégeant ainsi
leur génome.
Nous avons récemment démontré que les télomères raccourcissent avec l’âge
dans le rein humain et que ce phénomène est plus important dans le cortex que
dans la médullaire [13]. Ces résultats sont intéressants car il se trouve que le
vieillissement affecte plus le cortex que la médullaire. La signification de la perte
des télomères n’est cependant pas claire. Alors qu’elle est très certainement impor-
tante dans les cellules cancéreuses, sa contribution au phénotype de sénescence
rénale est inconnue. Cependant, étant donné l’hétérogéneité des populations cel-
lulaires rénales et la perte des noyaux avec l’âge, il est possible que la perte des
télomères soit impliquée dans certains aspects fondamentaux de la sénescence
rénale.
Mécanisme d’arrêt du cycle cellulaire dans les cellules sénescentes
La croissance cellulaire est régulée par l’expression de gènes inhibiteurs du cycle
cellulaire et par la répression de régulateurs positifs du cycle. Les kinases dépen-
dantes des cyclines ou cdk reçoivent et intègrent des signaux régulateurs du cycle
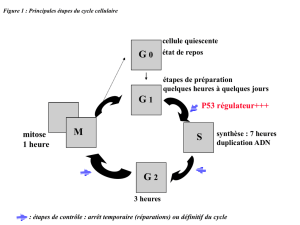
Nombre de divisions cellulaires
Longueur des télomères
Cellules germinales :
Crise (M2) :
Cellules somatiques qui continuent à se diviser
La limite de Hayflick (M1) :
Cellules tumorales
Cellules somatiques :
et immortalisées :
Cellules souches :
la télomérase est active :
la longueur des télomères
est stable
la télomérase est active :
la longueur des télomères
est maintenue
la télomérase est inactive transitoirement :
la longueur des télomères diminue régulièrement
la plupart des cellules meurent
la télomérase est inactive :
la longueur des télomères
diminue la télomérase est inactive :
la longueur des télomères
diminue
la plupart des cellules arrêtent
de se diviser
FIG. 1. — L’hypothèse du télomère. La télomérase, active dans les cellules germinales,
maintient des télomères longs et stables, mais elles est réprimée dans la plupart des cel-
lules somatiques normales, résultant en un raccourcissement des télomères dans les cel-
lules en division. Au stade M1, la limite de Hayflick, il existe une perte de télomère
présumée critique dans un ou plusieurs chromosomes ce qui engendre un signal d’arrêt
du cycle cellulaire. Ceci correspond au phénotype de sénescence réplicative. Certains
événements peuvent permettre aux cellules somatiques de shunter le stade M1 sans acti-
ver la télomérase. Lorsque les chromosomes deviennent court à un certain niveau critique
sur un grand nombre de télomères, les cellules deviennent génomiquement instables et
entrent en crise (M2). Quelques rares clones qui activent la télomérase, échappent au
stade M2, stabilisent leur génome et acquièrent un capacité de croissance infinie.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%