Fréquence cardiaque et circulation coronaire

Acteurs & partenaires
Acteurs & partenaires
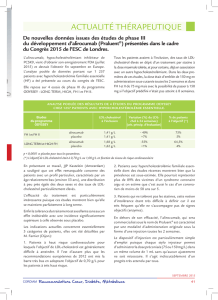
30
700
450
200
- 50 0 100 200 300 400
Stress pariétal du VG (g/cm2)
Sérum salé
Ivabradine
Aténolol
Temps en milliseconde
Figure 1. Comparaison chez le chien instrumenté de l’eff et de l’ivabradine, de l’aténolol et
d’un solvant neutre (sérum salé) sur le stress pariétal du ventricule gauche (VG). L’ivabradine
augmente plus que l’aténolol le temps de reperfusion.
La Lettre du Cardiologue - n° 401 - janvier 2007
Fréquence cardiaque et circulation coronaire
IPA. Berdeaux*
* Inserm U841, Fédération de cardiologie de l’hôpital Henri-
Mondor, Créteil.
L’
ischémie myocardique, responsa-
ble des diff érentes manifestations
de l’insuffi sance coronaire, résulte
d’un déséquilibre entre la demande et les
apports d’oxygène au myocarde. Dans ce
contexte, le rôle déterminant de la fré-
quence cardiaque fait depuis longtemps
des bêtabloquants la thérapeutique de
référence de l’angine de poitrine. Le déve-
loppement de nouveaux agents capables
de réduire la fréquence cardiaque sans
altérer l’inotropisme justifi e de revenir
aux modèles expérimentaux pour mieux
comprendre l’impact des diff érents agents
bradycardisants susceptibles d’être propo-
sés aux coronariens.
Les apports en oxygène au myocarde doi-
vent satisfaire à tout moment la demande
conditionnée par la fréquence cardiaque,
la contractilité myocardique, la pression
et les volumes ventriculaires gauches. La
fréquence cardiaque intervient aussi dans
cet équilibre en déterminant la durée de la
diastole, seule phase du cycle cardiaque au
cours de laquelle la perfusion des artères
coronaires est pleinement effi cace.
Le sous-endocarde est le plus exposé à l’is-
chémie par la relative pauvreté de sa vas-
cularisation, alors qu’il consomme deux
à trois fois plus d’oxygène que l’épicarde.
Dans des conditions normales, il bénéfi cie
toutefois de phénomènes régulateurs qui
assurent des débits au moins identiques
à ceux du sous-épicarde, quelle que soit
la fréquence cardiaque. Cette régulation
passe par des mécanismes métaboliques
locaux et par la mobilisation de la réserve
coronaire. La mise en jeu de cette dernière
explique le défi cit de perfusion sous-endo-
cardique observé aux fréquences cardia-
ques les plus élevées si les conditions de
vasodilatation sont déjà maximales (1).
Dans l’insuffi sance coronaire expérimentale
(exercice chez le chien après création d’une
sténose coronaire), la diminution de la fré-
quence cardiaque est le seul mécanisme
capable d’améliorer le défi cit de perfusion
des couches sous-endocardiques induit
par l’exercice physique (2). Dans de telles
conditions, cet eff et, apprécié sur l’épaissis-
sement de la paroi ventriculaire gauche et
l’installation d’une sidération myocardique,
peut être observé avec un agent réduisant
exclusivement la fréquence cardiaque. Il se
manifeste même lorsque l’administration
du produit intervient après l’installation
de l’ischémie (3).
En clinique humaine, lors d’une épreuve
d’eff ort, le temps de perfusion diastoli-
que au seuil d’ischémie est étroitement
corrélé au degré de sévérité de la sté-
nose coronaire (4). De ce fait, pour un
degré de sténose donné, plus on allonge
la durée de perfusion diastolique, plus
on augmente le seuil d’ischémie. Ainsi,
1 % d’augmentation de la durée du temps
de perfusion diastolique correspond à
une augmentation de 6 % du débit sous-
endocardique, ce qui peut être critique
au voisinage du seuil d’ischémie (1). À
l’inverse, une réduction de 2 à 5 % de
ce temps peut induire une diminution
dramatique de ce débit et précipiter vers
un épisode ischémique (4).
Il est désormais possible d’agir sur la seule
durée de la perfusion diastolique grâce à
un agent spécifi quement bradycardisant
comme l’ivabradine, un inhibiteur des
courants entrants If qui jouent un rôle
important dans la dépolarisation diasto-
lique spontanée.
On peut également démontrer au cours
d’une ischémie induite expérimentale-
ment que la réduction de la fréquence
cardiaque obtenue à l’effort avec l’ad-
ministration d’un bêtabloquant est
responsable d’une amélioration de la
contractilité segmentaire (reflet de la

Acteurs & partenaires
Acteurs & partenaires
31
Sous décalage
du segment ST
Avant traitement
Après traitement Dysfonction
myocardique
régionale
10
0
- 10
- 20
- 30
- 40
- 50
- 60
1,5
1,0
0,5
0,0
*** ***
**
Ivabradine Propranolol Solvant
Ivabradine Propranolol Vecteur
millivolt
Raccourcissement systolique
(% de modication)
Figure 3. Comparaison chez le microporc instrumenté avec sténose fi xe de l’interventriculaire
antérieure, de l’eff et de l’ivabradine, du propranolol et d’un solvant neutre (sérum salé) sur
l’ischémie régionale ventriculaire gauche induite par l’exercice. L’ivabradine et le propranolol
réduisent dans les mêmes proportions le sous-décalage du segment ST, mais l’ivabradine est
plus effi cace que le propranolol pour atténuer la dysfonction myocardique régionale induite
par l’exercice.
Contrôle
Ivabradine
Aténolol
10
8
6
4
2
0
Base Repos Repos + pacing Exercice Exercice + pacing
(ml O2/mn)
* signicativement diérent de contrôle. † : significativement différent de ivabradine.
**
*†
†
Figure 2. Comparaison chez le chien instrumenté de l’eff et de l’ivabradine, de l’aténolol
et d’un solvant neutre (sérum salé) sur la consommation d’oxygène au cours de l’exercice.
L’ivabradine, comme l’aténolol, permet de réduire la consommation d’oxygène à l’eff ort,
mais le retour à la normale de la dysfonction contractile en fi n d’exercice s’eff ectue plus
rapidement qu’avec l’aténolol.
Ivabradine 2 x 5 mg
versus 1 x aténolol 50 mg
à M1
Ivabradine 2 x 7,5 mg
versus 1 x aténolol 100 mg
à M4
Ivabradine 2 x 10 mg
versus 1 x aténolol 100 mg
à M4
595
286
300
286
298
286
nAténolol Ivabradine
- 35 sec + 35 sec
6,7 [- 7,4 ; 20,8]
p < 0,001
10,3 [- 8,3 ; 28,8]
p < 0,001
15,7 [- 2,9 ; 34,3]
p < 0,001
p de non infériorité
Limites d’équivalence
Figure 4. Comparaison de l’eff et de l’ivabradine et de l’aténolol sur la durée de l’exercice chez
939 coronariens stables (étude INITIATIVE).
La Lettre du Cardiologue - n° 401 - janvier 2007
perfusion myocardique), et que cet effet
disparaît quand l’effet bradycardisant
de ce bêtabloquant est neutralisé par
un entraînement électrosystolique auri-
culaire (2). Le fait que le même résul-
tat soit obtenu avec un agent réduisant
exclusivement la fréquence cardiaque
prouve bien que la réduction de celle-ci
est une condition à la fois nécessaire et
suffisante pour atténuer la dysfonction
contractile d’un myocarde ischémique
(5, 6).
Toutefois, les modèles expérimentaux
révèlent aussi les conséquences sur-
ajoutées de l’eff et inotrope négatif des
bêtabloquants. La comparaison directe
du propranolol et de l’ivabradine montre
que l’un et l’autre diminuent la fréquence
cardiaque au repos et limitent son aug-
mentation à l’eff ort, mais que l’ivabra-
dine augmente signifi cativement plus que
l’aténolol, le temps de perfusion diastoli-
que parce que cet inhibiteur des courants
If est, à la diff érence des bêtabloquants,
dépourvu d’eff ets inotrope et lusitrope
négatifs (fi gure 1) [7]. Cette diff érence
entre les deux substances est particuliè-
rement marquée à l’eff ort (8). Si, du fait
de ses propriétés inotropes négatives, le
propranolol réduit plus la consommation
d’oxygène du myocarde que l’ivabradine
(fi gure 2), celle-ci améliore les conditions
de la perfusion myocardique en diastole
alors que l’eff et inverse est observé avec
un bêtabloquant (7). Au bilan, les deux
substances atténuent de manière compa-
rable le sous-décalage du segment ST en
cas de sténose coronaire, mais contraire-
ment au propranolol, l’ivabradine amé-
liore de façon signifi cative la dysfonction
myocardique régionale induite au cours
même de l’eff ort (fi gure 3) [9] et immé-
diatement après (8). De plus, la contracti-
lité segmentaire s’améliore aussi lorsque
l’ivabradine est administrée après l’eff ort,
alors qu’elle se dégrade dans les mêmes
conditions avec le bêtabloquant, témoi-
gnant d’une aggravation de la sidération
induite par l’eff ort dans le territoire de
la sténose (8).
L’effi cacité anti-ischémique de l’ivabradine
a été démontrée en clinique, notamment
dans une étude conduite versus aténolol
(100 mg x 1/j) chez 939 coronariens aux
posologies de 5 mg x 2/j, 7,5 mg x 2/j et

Acteurs & partenaires
Acteurs & partenaires
DÉNOMINATION : CADUET®5 mg/10 mg, 10 mg/10 mg comprimés pelliculés. COMPOSITION : 5 mg ou 10 mg d’amlodipine (sous forme de bésilate) et 10 mg d’atorvastatine (sous forme calcique trihydratée) pour un comprimé pelliculé. DONNÉES CLINIQUES :
• Indications thérapeutiques : prévention des événements cardiovasculaires chez des patients hypertendus ayant 3 facteurs de risque cardiovasculaire associés avec un cholestérol normal à modérément élevé, sans maladie coronaire avérée et, chez lesquels, selon
les recommandations en vigueur, l’utilisation concomitante d’amlodipine et d’une faible dose d’atorvastatine est adaptée. CADUET doit être utilisé lorsque la réponse au régime et aux autres mesures non pharmacologiques est inadéquate. • Posologie et mode
d’administration : Posologie initiale usuelle de 5 mg/10 mg une fois par jour, par voie orale, pouvant aller jusqu’à 10 mg/10 mg une fois par jour si un contrôle plus strict de la pression artérielle est nécessaire. A prendre à tout moment de la journée, avec ou
sans aliments. Peut être utilisé seul ou en association avec d'autres anti-hypertenseurs mais ne doit pas être utilisé en association à d'autres inhibiteurs calciques ou une autre statine. Eviter généralement l’association de CADUET et de fibrates. Patients atteints
d'insuffisance rénale, sujet âgé : aucune ajustement posologique nécessaire. Patients atteints d'insuffisance hépatique : contre-indiqué. Enfants/Adolescents : utilisation non recommandée. • Contre-indications : hypersensibilité aux dihydropyridines, à l'amlodipine,
à l'atorvastatine ou à l'un des excipients de ce médicament; affection hépatique évolutive ou augmentation persistante et inexpliquée des transaminases sériques dépassant 3 fois la limite supérieure de la normale ; grossesse et allaitement ; association avec
l'itraconazole, le kétoconazole, la télithromycine. • Mises en garde spéciales et précautions particulières d’emploi : Effets hépatiques : réaliser des épreuves fonctionnelles hépatiques avant puis régulièrement après l'instauration du traitement, ainsi qu’en cas
de signes ou symptômes évocateurs d'une altération hépatique. En cas d'élévation du taux sérique des transaminases, surveiller jusqu'à normalisation. Arrêter le traitement en cas d’augmentation persistante des ALAT ou des ASAT dépassant 3 fois la limite supérieure
de la normale (LNS). Utiliser avec prudence chez les patients consommant des quantités importantes d'alcool et chez ceux présentant une insuffisance hépatique et/ou des antécédents d'affection hépatique. Effets musculaires : comme les autres inhibiteurs de
l'HMG-CoA réductase, l'atorvastatine peut affecter les muscles squelettiques et entraîner des myalgies, myosites et myopathies, pouvant rarement évoluer vers une rhabdomyolyse, caractérisée par des taux élevés de CPK (plus de 10 fois la LSN), une myoglobinémie
et une myoglobinurie et pouvant entraîner une insuffisance rénale, et être fatale dans certains cas. Chez les patients asymptomatiques traités par statine, pas de recommandation de dosage régulier des taux de CPK ou d'autres enzymes musculaires. Chez les patients
présentant des facteurs prédisposant à une rhabdomyolyse et chez ceux présentant des symptômes musculaires pendant un traitement par une statine, recommandation de dosage des CPK avant toute initiation d'un traitement par statine. Avant initiation du traitement :
contrôler le taux de CPK dans les situations suivantes : patients âgés (> 70 ans), insuffisance rénale, hypothyroïdie, antécédent personnel ou familial de maladies musculaires génétiques, antécédent personnel de toxicité musculaire lors d'un traitement par une statine
ou un fibrate, abus d'alcool. Dans ces situations, réévaluer régulièrement le bénéfice/risque du traitement et assurer une surveillance clinique régulière. Ne pas débuter le traitement si le taux basal de CPK est significativement élevé (plus de 5 fois la LSN). Mesure
de la CPK : ne pas mesurer la CPK après un exercice physique important ni en présence d'une autre cause possible d'augmentation. En cas d'élévation significative de la CPK (plus de 5 fois la LSN) avant traitement, recontrôler systématiquement dans les 5 à 7 jours
pour confirmer les résultats. Si le taux initial de CPK > 5 fois la normale est confirmé, ne pas initier le traitement. Pendant le traitement : demander aux patients de signaler rapidement toute douleur musculaire inexpliquée, crampe ou faiblesse musculaire, en
particulier si elles s'accompagnent de malaise ou de fièvre ; en cas d’apparition de symptômes sous traitement effectuer un dosage de CPK, interrompre le traitement si le taux CPK est significativement élevé (plus de 5 fois la LSN); si les symptômes musculaires
sont sévères et provoquent une gêne quotidienne envisager l’arrêt du traitement, même si le taux de CPK ne dépasse pas 5 fois la LSN ; si les symptômes disparaissent et que le taux de CPK redevient normal envisager la réintroduction de CADUET sous étroite
surveillance. Comme avec les autres statines, risque de rhabdomyolyse majoré lorsque CADUET est associé avec certains médicaments tels que la ciclosporine, l'érythromycine, la clarithromycine, l'itraconazole, le kétoconazole, la néfazodone, l'acide nicotinique, le
gemfibrozil, les fibrates ou les inhibiteurs de protéases du VIH. • Interactions avec d’autres médicaments et autres formes d’interaction : Associations contre-indiquées : itraconazole, kétoconazole; télithromycine; gemfibrozil et autres fibrates. Associations
déconseillées : dantrolène (perfusion). Associations nécessitant des précautions d’emploi : baclofène ; inducteurs du CYP3A4 (agents anticonvulsivants tels que carbamazépine, phénobarbital, phénytoïne, fosphénytoïne, primidone, rifampicine) ; inhibiteurs du
cytochrome P450 3A4 (tels que ciclosprine, antibiotiques macrolides, néfazodone, antifongiques azolés, inhibiteurs de protéases du VIH); inhibiteurs de protéases ; warfarine ; acide nicotinique. Associations à prendre en compte : alpha-1-bloquants à visée urologique
(prazosine, alfuzosine, doxazosine, tamsulosine, térazosine) ; amifostine ; antidépresseurs imipraminiques, neuroleptiques ; bêta-bloquants dans l'insuffisance cardiaque (bisoprolol, carvédilol, métoprolol) ; corticoïdes, tétracosactide ; autres agents antihypertenseurs
(tels que bêta-bloquant, antagoniste des récepteurs à l'angiotensine II, diurétique, inhibiteur de l'enzyme de conversion) ; sildénafil ; anti-acides ; jus de pamplemousse ; contraceptifs oraux ; colestipol. Autres interactions : phénazone. • Grossesse et allaitement :
contre-indiqué. • Effets sur l’aptitude à conduire des véhicules et à utiliser des machines : survenue possible de vertiges. • Effets indésirables : Au cours des essais cliniques avec CADUET, aucun événement indésirable particulier propre à cette association n'a
été observé. Les événements indésirables se sont limités à ceux rapportés antérieurement pour l'amlodipine et/ou l'atorvastatine (voir ci-dessous). Les événements indésirables ci-dessous, listés selon la classification MedDRA par système-organe et par ordre de
fréquences, concernent l'amlodipine et l'atorvastatine individuellement. Très fréquents : ≥1/10, fréquents : ≥1/100 et <1/10, peu fréquents rares : ≥1/10 000 et <1/1000, très rares : <1/10 000. Amlodipine : Fréquents : somnolence, vertiges, céphalées,
palpitations, bouffées vasomotrices, douleurs abdominales, nausées, œdème, œdème périphérique, fatigue. Peu fréquents : prise de poids, perte de poids, insomnie, troubles de l'humeur, tremblements, hypoesthésies, paresthésies, troubles visuels, acouphène,
syncope, hypotension, dyspnée, rhinite, vomissements, dyspepsie, troubles du transit intestinal, sécheresse buccale, modification du goût, alopécie, purpura, décoloration de la peau, augmentation de la sudation, prurit, éruption, arthralgie, myalgie, crampes
musculaires, douleur dorsale, trouble de la miction, nycturie, pollakiurie, impuissance, gynécomastie, douleur thoracique, asthénie, douleur, malaise. Rares : douleur angineuse. Très rares : leucopénie, thrombocytopénie, réaction allergique : urticaire, hyperglycémie,
troubles de l'humeur, hypertonie, neuropathie périphérique, infarctus du myocarde, arythmie (dont bradycardie, tachycardie ventriculaire et fibrillation auriculaire), vascularite, toux, hyperplasie gingivale, pancréatite, hépatite, ictère cholestatique, oedème de Quincke,
érythème polymorphe, syndrome de Stevens-Johnson, élévation des enzymes hépatiques : ASAT, ALAT (principalement en relation avec une cholestase). Atorvastatine : Fréquents : insomnie, vertiges, céphalées, hypoesthésies, paresthésies, douleurs abdominales,
nausées, dyspepsie, diarrhées, constipation, flatulence, prurit, éruption, arthralgie, myalgie, douleur thoracique, asthénie, élévation des enzymes hépatiques : ASAT, ALAT (principalement en relation avec une cholestase), augmentation des CPK. Peu fréquents :
thrombocytopénie, réaction allergique : urticaire, hyperglycémie, prise de poids, hypoglycémie, anorexie, neuropathie périphérique, amnésie, acouphène, vomissements, alopécie, douleur dorsale, impuissance, malaise. Rares : pancréatite, hépatite, ictère cholestatique,
éruptions bulleuses, crampes musculaires, myosites, œdème, œdème périphérique. Très rares : œdème de Quincke, syndrome de Stevens-Johnson, syndrome de Lyell, rhabdomyolyse, myopathie, tendinopathies parfois compliquées de rupture. PROPRIETES
PHARMACOLOGIQUES : • Propriétés pharmacodynamiques : Inhibiteur de l’HMG-CoA réductase, autres associations. Code ATC : C10BX03. PRESENTATION ET NUMERO D’IDENTIFICATION ADMINISTRATIVE : CADUET 5mg/10mg, comprimés pelliculés, boîte de 30 :
n°369 305-0. CADUET 10mg/10mg, comprimés pelliculés, boîte de 30 : n°369 298-4. PRIX : 33,38 �(pour les 2 dosages). CTJ : 1,11 �.CONDITIONS DE PRESCRIPTION ET DELIVRANCE : Liste I. Remb. Sec. Soc. à 65 %. Collect. EXPLOITANT : PFIZER –
23-25, avenue du Dr Lannelongue – 75014 Paris – Tél. (information médicale) : 01 58 07 34 40. ®marque déposée. Date de révision d’AMM : 27 février 2006. Pour plus d’informations, se référer au Résumé des Caractéristiques du Produit. Version n° 003-10/06
ML_180x120 28/11/06 15:53 Page 1 (Noir/Process Black film)
Pfizer S.A. - 23-25, avenue du Docteur Lannelongue - F-75668 Paris Cedex 14
Tél : (+33) 1 58 07 30 00 - Fax : (+33) 1 58 07 30 01
Société par Actions Simplifiées au capital de 38 200
Locataire-gérant de Pfizer Holding France
RCS Paris 433 623 550 - Siren 433 623 550
N° TVA intra-communautaire
FR 73 433 623 550
Janvier 2007
Cher Confrère,
Nous avons le plaisir de vous informer de la mise à disposition
de notre nouvelle spécialité :
CADUET®est le seul médicament indiqué dans la prévention des évènements cardiovasculaires, chez des patients
hypertendus ayant 3 facteurs de risque cardiovasculaire* associés avec un cholestérol normal à modérément élevé, sans
maladie coronaire avérée, et chez lesquels, selon les recommandations en vigueur, l’utilisation concomitante d’amlodipine
et d’une faible dose d’atorvastatine est adaptée. CADUET®doit être utilisé lorsque la réponse au régime et aux autres
mesures non pharmacologiques est inadéquate(1).
Les patients hypertendus ayant au moins 3 facteurs de risque cardiovasculaire* associés peuvent présenter, comme vous
le savez, un risque de complications cardiovasculaires(2). Diminuer ce risque doit donc être l’objectif de la prise en charge
de ces patients. C’est pourquoi Pfizer met à votre disposition une nouvelle solution thérapeutique, CADUET®, apportant une
protection cardiovasculaire spécifique à vos patients hypertendus, non coronariens, ayant 3 facteurs de risque associés.
CADUET®doit être initié à la dose de 5 mg/10 mg une fois par jour.
CADUET®est une spécialité inscrite sur la liste I et remboursée à 65% par la Sécurité Sociale. Son prix public TTC est
de 33,38 pour la boîte de 30 comprimés de 5 mg/10 mg et 10 mg/10 mg d’amlodipine et d’atorvastatine.
Notre service d’Information Médicale ainsi que nos Délégués Médicaux restent à votre entière disposition pour toute
demande d’information complémentaire.
Nous vous prions d’agréer, Cher Confrère, l’expression de nos meilleures salutations.
Françoise TERE Docteur Yannick PLETAN
Pharmacien Responsable Vice-président, Division Scientifique et Médicale
Posologie : 1 seul comprimé par jour
* facteurs de risque cardiovasculaire de l’étude ASCOT : sexe masculin, âge (≥55 ans chez l’homme et 65 ans chez la femme), tabagisme, diabète, antécédent de coronaropathie chez un parent du premier degré, CT/HDL>6, artériopathie périphérique, HVG, antécédent
d’AVC, anomalie électrocardiographique spécifique, protéinurie/albuminurie.
(1) RCP
(2) Sever PS et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm (ASCOT –LLA) :
a multicentre randomised controlled trial. Lancet 2003; 361: 1149-58.
NOUVEAU
CADM 1775 - 09/06 - B-EST - Tous droits réservés Pfizer SAS 2006 au capital de 38200 euros, RCS PARIS 433 623 550. Locataire gérant de Pfizer Holding France.
LETTRE_210x270 11/12/06 17:17 Page 1
La Lettre du Cardiologue - n° 401 - janvier 2007
10 mg x 2/j. Lors d’une épreuve ergomé-
trique, la durée totale de l’exercice a été
augmentée aussi bien sous ivabradine que
sous aténolol, permettant ainsi de vérifi er
l’hypothèse de non-infériorité à chacune
de ces posologies (p < 0,001) (fi gure 4)
[10].
Ainsi, les données expérimentales et
cliniques témoignent de l’importance
du seul contrôle de la fréquence cardia-
que pour améliorer les conditions de
perfusion et de contractilité du muscle
cardiaque exposé à l’ischémie en cas de
sténose coronaire.
Le double effet des bêtabloquants,
qui a longtemps été considéré comme
responsable d’un impact favorable sur
l’insuffisance coronaire, pourrait être
reconsidéré au regard de l’effet au moins
équivalent d’agents purement bradycar-
disants. ■
RÉFÉRENCES
BIBLIOGRAPHIQUES
1. Bache RJ, Cobb FR. Eff ect of maximal coronary
vasodilation on transmural myocardial perfusion
during tachycardia in the awake dog. Circ Res 1977;
41(5):648-53.
2. Guth BD, Heusch G, Seitelberger R et al. Role
of heart rate reduction in the treatment of exer-
cise-induced myocardial ischaemia. Eur Heart J
1987;8(Suppl L):61-8.
3. Monnet X, Ghaleh B, Colin P et al. Eff ects of heart
rate reduction with ivabradine on exercise-induced
myocardial ischemia and stunning. J Pharmacol
Exp er 2001;299(3):1133-9.
4. Ferro G, Duilio C, Spinelli L et al. Relation
between diastolic perfusion time and coronary ar-
tery stenosis during stress-induced myocardial is-
chemia. Circulation 1995;92(3):342-7.
5. Tomoike H, Ross Jr J, Franklin D et al. Improve-
ment by propranolol of regional myocardial dys-
function and abnormal coronary fl ow pattern in
conscious dogs with coronary narrowing. Am J Car-
diol 1978;41(4):689-96.
6. Indolfi C, Guth BD, Miura T et al. Mechanisms
of improved ischemic regional dysfunction by bra-
dycardia. Studies on UL-FS 49 in swine. Circulation
1989;80(4):983-93.
7. Colin P, Ghaleh B, Monnet X et al. Contributions
of heart rate and contractility to myocardial oxygen
balance during exercise. Am J Physiol Heart Circ
Physiol 2003; 284(2):H676-82.
8. Monnet X, Colin P, Ghaleh B, Hittinger L, Giu-
dicelli JF, Berdeaux A. Heart rate reduction during
exercise-induced myocardial ischaemia and stun-
ning. Eur Heart J 2004;25(7):579-86.
9. Vilaine JP, Bidouard JP, Lesage L, Reure H, Pe-
glion JL. Anti-ischemic eff ects of ivabradine, a selec-
tive heart rate-reducing agent, in exercise-induced
myocardial ischemia in pigs. J Cardiovasc Pharma-
col 2003;42(5):688-96.
10. Tardif JC, Ford I, Tendera M, Bourassa MG, Fox K.
Effi cacy of ivabradine, a new selective I(f) inhibitor,
compared with atenolol in patients with chronic sta-
ble angina. Eur Heart J 2005;26(23):2529-36.
32
1
/
3
100%