etude anocor etude anocor - Société Française de Cardiologie

ETUDE ANOCOR
1
Schéma de l’étude ANOCOR
Promoteur
Titre de l’étude
Type d’étude
Cohorte
Centre coordinateur
Coordinateur
principal
Techniciens de
recherche
clinique
Comité de pilotage
Médecins
participants
Assistance Publique – Hôpitaux de Paris
Etude observationnelle sur les anomalies de connexion proximale des
artères coronaires (ANOCOR)
Etude multicentrique observationnelle de cohorte de patients
Patients ayant une ANOCOR détectée par une coronarographie ou un
scanner cardiaque ou une IRM cardiaque
Département de Cardiologie
Centre Hospitalier Bichat-Claude Bernard
46 rue Henri Huchard
75018 Paris
Docteur Pierre Aubry
Tel 01 40 25 86 65 Fax 01 40 25 88 65
Hélène Abergel
Tel 01 40 25 80 80 bip 2623
Reza Farnoud
Tel 01 40 25 80 80 bip 2624
Tel 01 40 25 66 01 Fax 01 40 25 66 98
Docteur Pierre Aubry, cardiologue
Docteur Candice Estellat, épidémiologiste
Docteur Fabien Hyafil, cardiologue
Centre Hospitalier Bichat-Claude Bernard
46 rue Henri Huchard
75018 Paris
Cardiologues membres du GACI (Groupe Athérome et Cardiologie
Interventionnelle), groupe de travail de la Société Française de
Cardiologie
ETUDE ANOCOR

ETUDE ANOCOR
2
Contexte et
justification de
l’étude
Introduction
Les anomalies congénitales des artères coronaires constituent une entité
polymorphe. Le terme anomalie de naissance, souvent utilisé, est sans doute mal
approprié, car c’est l’artère coronaire qui va se connecter à l’aorte lors de sa
maturation. Aussi, le terme connexion est utilisé dans cette étude qui concerne
uniquement les ANOmalies de connexion proximale des artères CORonaires
(ANOCOR), c’est à dire à leur origine selon une définition angiographique plus
classique. Les ANOCOR sont intéressantes à considérer pour les questions qu’elles
suscitent encore. La conduite à tenir reste mal codifiée pour les ANOCOR dites à
risque, tant pour les indications que pour les techniques de revascularisation,
surtout en cas de découverte fortuite. La mise en place d’une étude prospective
avec une mise en commun des données relatives aux ANOCOR détectées
(particularités anatomiques, cliniques et angiographiques, apport de l’imagerie
en coupe, choix thérapeutiques, suivi clinique) pourrait permettre de proposer à
terme une conduite plus factuelle aux praticiens confrontés souvent à une
décision difficile.
Prévalence
La prévalence angiographique globale des ANOCOR proximales varie de 0.6 à 3 %
selon les séries et est <0.1% pour le tronc gauche (Rigatelli et al. 2008). Le
diagnostic angiographique est généralement facile, avec un trajet initial du
vaisseau ectopique parfois incertain ou erroné. L’imagerie en coupe (scanner
cardiaque et imagerie par résonance magnétique cardiaque) occupe une place
primordiale pour préciser les rapports avec les structures artérielles adjacentes.
Le développement du scanner cardiaque peut amener au diagnostic d’ANOCOR
sans la réalisation d’une coronarographie. Pour éviter un diagnostic par excès, la
reconnaissance d’une ANOCOR nécessite de définir les variantes anatomiques qui
sont présentées dans l’annexe I.
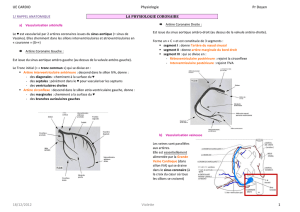
ANOCOR les plus fréquentes
Les principales ANOCOR, présentées dans l’annexe II, sont la connexion d’un sinus
controlatéral ou d’une artère controlatérale, la connexion d’un sinus normal en
position excentrée, la connexion aortique anormalement haute, la coronaire dite
unique et la connexion d’une coronaire avec l’artère pulmonaire. Pour rejoindre
leur territoire myocardique habituel, les ANOCOR ont plusieurs trajets possibles
selon leurs rapports avec les troncs artériels : prépulmonaire, interartériel,
intraseptal et rétroaortique. Des méthodes angiographiques existent pour classer
le trajet, mais elles peuvent être prises en défaut. L’objectif de l’imagerie en
coupe est d’identifier le trajet d’une artère coronaire ectopique, en particulier
pour différencier un trajet interartériel de mauvais pronostic d’un trajet
intraseptal de pronostic plus favorable (Kim et al. 2006).
Formes symptomatiques
Hors une maladie athéromateuse associée souvent révélatrice de l’ANOCOR après
40 ans, la gravité de certaines formes anatomiques est bien établie, alors que la
plupart des ANOCOR sont considérées de simples curiosités anatomiques bénignes.
Parmi ces dernières, on peut citer les formes avec un trajet initial prépulmonaire,
intraseptal ou rétroaortique. Par contre, un trajet interartériel doit toujours être
pris en considération. Il peut concerner le tronc commun ou l’IVA, mais aussi la
coronaire droite. La fréquence d’un trajet interartériel est plus élevée pour la
coronaire droite que pour la coronaire gauche. Dans une série autopsique de 49
connexions ectopiques du tronc commun et de 52 connexions ectopiques de la
coronaire droite, 57% des ANOCOR gauches et 25% des ANOCOR droites sont
associées à une mort subite, avec un trajet interartériel associé dans la grande

ETUDE ANOCOR
3
Contexte et
justification de
l’étude
(suite)
majorité des cas (Virmani et al. 2001). La particularité de ces formes à risque est
son mode de révélation, souvent une mort subite survenant un adulte jeune lors
d’un effort violent. Des signes cliniques prémonitoires évocateurs d’ischémie
myocardique sont inconstants, de même que des anomalies ischémiques d’effort
si une recherche a été réalisée.
Physiopathologie
Le mécanisme des accidents cardiaques graves reste incertain. Un orifice non
circulaire, une hypoplasie proximale ou une compression latérale par l’aorte sont
évoqués. Les rapports anatomiques entre le vaisseau ectopique et la paroi de
l’aorte sont primordiaux à considérer, car ils pourraient expliquer la gravité de
certaines formes. Le vaisseau ectopique peut suivre sur une distance variable la
paroi aortique avec un trajet tangentiel extramural, juxtamural ou intramural.
Les techniques habituelles d’imagerie ne permettent pas facilement de
différencier ces trajets. L’échographie endocoronaire a été proposée pour aider à
leur distinction, et aussi pour analyser la forme de l’ostium, ainsi que les
diamètres respectifs du vaisseau dans ses portions intramurale et extramurale
(Angelini et al. 2007). Une séquelle d’infarctus est rarement notée dans les séries
autopsiques, par contre des zones de fibrose pouvant correspondre à des
phénomènes d’ischémie répétitive chronique ont été observées chez les jeunes
athlètes décédés de mort subite (Basso et al. 2000). Pour expliquer cette
dernière, une fibrillation ventriculaire est un mécanisme possible. Cette ischémie
chronique déclenchée par des efforts répétés et intenses est rarement dépistée
par les techniques habituelles, et reste donc longtemps silencieuse. Son
mécanisme demeure incertain, mais une origine multifactorielle est probable. La
compression entre l’aorte et l’infunfibulum pulmonaire au cours de l’effort,
longtemps présentée comme le mécanisme principal, n’a jamais été clairement
démontrée. Il faut revenir aux particularités anatomiques des formes à risque
pour envisager d’autres mécanismes. Un trajet intramural implique une
déformation de l’ostium avec une surface réduite. Par ailleurs, l’intégration dans
la paroi aortique est responsable d’une hypoplasie relative proximale du vaisseau
ectopique. Cette dernière, pas toujours évidente en angiographie, peut être
visualisée par imagerie endocoronaire (Angelini et al. 2006). Ces anomalies
morphologiques lorsqu’elles sont associées pourraient entraîner une ischémie
myocardique sévère lors d’une demande particulièrement importante en
oxygène. La moindre fréquence de formes symptomatiques pour la coronaire
droite ectopique avec trajet interartériel pourrait s’expliquer par une zone
myocardique exposée moins importante.
Prise en charge des formes à risque ou symptomatiques
La découverte d’une ANOCOR doit être associée à la détermination de sa gravité
potentielle. Pour les formes anatomiques considérées bénignes, l’abstention
thérapeutique est de règle, hors une maladie athéromateuse associée
nécessitant un geste de revascularisation. Pour les formes anatomiques à risque,
un traitement chirurgical doit être discuté pour le tronc gauche. Il n’existe pas de
recommandations françaises ou européennes sur ce sujet. Des recommandations
américaines ont été publiées récemment (Warnes et al. 2008), avec des avis
assez directifs (classes IB et IC). L’indication chirurgicale porte principalement
sur les ANOCOR proximales gauches avec un trajet interartériel. La méthode de
choix est de réaliser une anastomose latérolatérale du tronc dans le sinus gauche
en créant ainsi un nouvel ostium. La dissection du tronc pour le réimplanter dans
le sinus gauche est techniquement très difficile avec le risque supplémentaire de
créer artificiellement des sténoses. Un patch de péricarde autologue permet
d’élargir le tronc si nécessaire au niveau du nouvel ostium. Une ligature du

ETUDE ANOCOR
4
Contexte et
justification de
l’étude
(suite)
Objectif
principal
Objectifs
secondaires
Critères
d’évaluation
Critères de
sélection des
patients
vaisseau ectopique avec implantation d’un pontage est une autre alternative.
Une réparation chirurgicale est plus rarement proposée en cas d’ANOCOR droite,
situation où une angioplastie a été proposée (Hariharan et al. 2002)). L’âge,
l’existence de symptômes ou d’une ischémie documentée, le myocarde exposé,
une maladie athéromateuse associée, et l’exposition à des efforts intenses sont
les facteurs intervenant dans la discussion. La décision d’intervenir ou non reste
souvent difficile dans les formes à risque découvertes fortuitement chez des
patients âgés de plus de 40 ans. Une forme considérée comme bénigne, mais
symptomatique, peut aussi prêter à discussion thérapeutique.
L’objectif principal de cette étude est de décrire les stratégies thérapeutiques
choisies (abstention thérapeutique, traitement médical, traitement percutané,
traitement chirurgical) pour les principaux types d’ANOCOR lorsque celles-ci sont
diagnostiquées.
décrire les circonstances de découverte de l’ANOCOR
décrire la répartition relative de chaque type d’ANOCOR
décrire la morbimortalité cardiaque à 1, 3 et 5 ans pour les principaux
types d’ANOCOR
évaluer l’impact des différentes stratégies thérapeutiques sur la
morbimortalité cardiaque à 1, 3 et 5 ans pour les ANOCOR classées à risque
Les principaux critères d’évaluation seront les suivants :
- le type d’ANOCOR comme défini dans l’annexe II
- la sévérité de l’ANOCOR : chaque anomalie sera classée par le comité de
validation des anomalies coronaires en deux groupes (ANOCOR bénignes et
ANOCOR à risque) en fonction de leur description anatomique et de leur
retentissement initial
- la symptomatologie clinique initiale, le lien de la symptomatologie avec l’effort
- les examens paracliniques initiaux
- le mode de découverte de l’ANOCOR
- la décision thérapeutique initiale : abstention, traitement médical, traitement
percutané, traitement chirurgical
- le statut vital à 1, 3 et 5 ans
- la survenue d’événements cardiovasculaires à 1, 3 et 5 ans : hospitalisation
en cardiologie ou en chirurgie cardiaque, décès, infarctus du myocarde,
accident vasculaire cérébral, coronarographie, angioplastie coronaire,
intervention chirurgicale cardiaque
- un critère composite de morbimortalité cardiovasculaire regroupant les
éléments suivants : décès, infarctus du myocarde, accident vasculaire
cérébral, angioplastie coronaire, intervention chirurgicale cardiaque
La population source de l’étude est la population de sujets ayant une ANOCOR.
critères d’inclusion :
patient ayant une ANOCOR visualisée par une coronarographie ou un scanner
cardiaque ou une IRM cardiaque datant de moins de 6 mois
patient ayant compris la note d’information et acceptant de participer à l’étude
âge supérieur à 18 ans
critères de non inclusion :
cardiopathie congénitale structurale associée touchant les troncs artériels
patient refusant de participer à l’étude

ETUDE ANOCOR
5
Critères de
sélection des
patients
(suite)
Déroulement
de l’étude
patient présentant une pathologie non cardiovasculaire mettant en
jeu le pronostic vital à brève échéance (<12 mois)
critère d’exclusion secondaire :
patient ayant une ANOCOR non confirmée par le comité de validation
L’étude se déroule sous la responsabilité du Département de Cardiologie du
Centre Hospitalier Bichat-Claude Bernard (centre coordinateur). Le protocole et
les modalités de réalisation de l’étude ont été validés par un comité scientifique
indépendant incluant des cardiologues, des radiologues, des chirurgiens
cardiaques et des spécialistes en épidémiologie et en biostatistiques.
Modalités de recrutement des cardiologues investigateurs
La base de sondage sera constituée par le fichier du GACI avec un appel à une
participation volontaire à l’étude. Chaque cardiologue interventionnel ayant
donné son accord de participation reçoit :
- un courrier de confirmation de sa participation
- un protocole simplifié de l’étude
- un classeur contenant 10 dossiers patients comprenant chacun :
- un feuillet d’identification patient à remplir par les patients acceptant de
participer
- un questionnaire de recueil de données médicales initiales anonyme en
duplicata
- des enveloppes T à l’adresse du centre coordinateur pour le retour du
questionnaire médical, du feuillet d’identification patient et la
correspondance avec le centre coordinateur.
Modalités de recrutement des patients
Durant la période d’inclusion de 3 ans, chaque cardiologue interventionnel doit
identifier les patients répondant aux critères d’éligibilité et leur proposer de
participer. Lors de l’inclusion d’un patient, le cardiologue doit :
- présenter l’étude au patient, lui remettre la note d’information et
rechercher sa non opposition
- compléter le questionnaire de recueil des données médicales initiales
- demander au patient de remplir le feuillet d’identification
- détacher les feuillets du questionnaire de recueil des données
médicales initiales et le feuillet d’identification et les adresser
séparément au centre coordinateur au moyen d’une enveloppe T.
Modalités de suivi des patients par le centre coordinateur
Les patients inclus font l’objet d’évaluation à 1, 3 et 5 ans à partir d’auto
questionnaires qui sont transmis directement aux patients par le centre
coordinateur. Les auto questionnaires de suivi sont à compléter sur papier.
Suivi à 1, 3 et 5 ans
Le patient reçoit par courrier à son domicile l’auto questionnaire de suivi et une
enveloppe T. Le patient doit compléter et transmettre au centre coordinateur
l’auto questionnaire de suivi.
Monitoring
Un contrôle qualité et un suivi centralisé sera organisé au sein du CIC-EC 801 à
partir de la réception des différents documents. La bonne réception et
l’exhaustivité des documents seront contrôlée avant envoi à la saisie. Des
contacts réguliers, soit par mail, soit par courrier, soit par téléphone seront
 6
6
 7
7
 8
8
1
/
8
100%