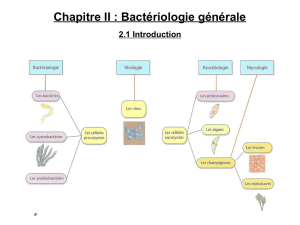
Physiologie bactérienne: Nutrition et Croissance

1
Faculté de Médecine d’Alger
Enseignement de Microbiologie
Première Post
-
Graduation
Année Universitaire 2012
-
2013
P
r. A. BENSLIMANI
Physiologie bactérienne: Nutrition et Croissance
DEFINITIONS :
La physiologie bacté
rienne consiste à étudier la nutrition, le métabolisme et la croissance des bactéries
en fonction des variations (naturelles ou contrôlées) du milieu dans lequel elles vivent.
Nutrition bactérienne
: c’est l'analyse des besoins élémentaires , énergétique
s et spécifiques
nécessaires au fonctionnement et à la croissance de la bactérie , ainsi que des facteurs physico
-
chimiques susceptibles de les influencer .
Métabolisme biochimique bactérien
: C’est l’ensemble des transformations chimiques
( anabolisme ou biosynthèse et catabolisme ou dégradation) qui assurent l’élaboration des constituants
bactériens et leur fonctionnement .
Croissance bactérienne
:
Dans un environnement optimal, la cellule bactérienne, grâce à son système
enzymatiqu
e très développé ,va donner naissance en peu de temps (20 minutes pour la majorité des
bactéries de l'environnement) , à deux bactéries filles qui lui sont identiques : On parle de croissance
bactérienne .Elle se manifeste par une augmentation numérique de
s cellules bactériennes et non pas une
augmentation de taille comme chez les organismes supérieurs ( homme, animal, plante).
En définitive, une bactérie se forme, se développe, vit et se reproduit puis dépérit et meurt.
CHAP I
–
NUTRITION ET CROISS
ANCE BACTERIENNE :
A
-
NUTRITION
:
Pour survivre et se multiplier , les bactéries ont besoin d’ une quantité plus ou moins importante de
substances minérales et organiques dites substances alimentaires ou nutriments.
La dégradation de ces aliments , que l
’on met à leur disposition dans les milieux de culture , va leur
fournir les éléments simples (Carbone , Azote , Minéraux) , et l’énergie , qu’elles vont réutiliser pour
synthétiser leurs propres constituants structuraux et enzymatiques
.
Les bactéries on
t toutes un certain nombre de besoins communs tels
: l’eau , une source d’énergie , une
source de Carbone , une source d’Azote et des éléments minéraux .
D’ailleurs , en examinant la composition chimique de la cellule bactérienne , on peut deviner ses
bes
oins nutritifs
:
La bactérie est faite en majorité d’eau
: 75 à 80 % de son poids total
L
a matière
sèche est faite de protéines (55%) , rRNA (16,7%), tRNA (3%), mRNA( 0,8%), DNA
(3,1%), lipides (9,1%), Lipopolysaccharides (3,4%), Peptidoglycanes (2,5%), vi
tamines (2,9%) et ions
inorganiques (1,0%).
En résumé, la matière bactérienne sèche comporte
:
95 %
: C , O, N , H , P, S 5 %
: K , Mg , Ca , Fe , Mn , Co , Cu , Zn

2
Donc,
la bactérie aura besoin de 3 types d’éléments nutritifs
:
1.Besoins élémentaires et énergétiques :
1
-
a
-
Les besoins élémentaire
s
:
-
L’eau
: Besoin
majeur,
il entre dans la composition de tous les milieux de
culture.
-
Le Carbone
: C’est un des éléments les plus abondant
s
de la bactérie
: il doit
ê
tre fourni en quantité suffisante .
L
e plus simple des composés carbonés est le
CO2 ou anhydride
carbonique.
On distingue les bactéries en 2 catégories
:
celles capables de se développer en milieu inorganique contenant le CO2
comme seule source de C
arbone
: Bactéries AUTOTROPHES (Stricte/
CO2
obligatoire,
Facultatif /CO2 ou composé organique)
ex. bactéries
photosynthétiques et la plupart des bactéries chimiolithotrophes)
celles qui exigent des composés organiques comme source de carbone
:
bactéries
HETEROTROPHES. Ainsi,
ces bactéries sont capables de
dégrader une panoplie de substances hydrocarbonées
:
Alcool,
acide
acétique,
acide lactique (molécules simples
),
polysaccharides
(complexes).
Le CO2 peut cependant jouer un rôle majeur chez
ces
bactéries,
en
intervenant dans la synthèse de certains métabolites
essentiels,
à travers
des réactions de carboxylation . ex.Brucella abortus .
-
L’Azote
: Les substances azotés entrent dans la composition des protéines
bactériennes.
L’azote peut être
fixé par la bactérie
:
sous forme d’azote
moléculaire,
c’est à dire la forme la plus
simple.
ex.
les Rhizobium
–
Azotobacter et certains Clostridiums.
Sous forme de composés inorganiques
:
Ex
. Nitrites par les Nitrobacter Ammoniac sous forme de sels
d’ammonium par les Nitrosomonas
Sous forme de composés organiques R
-
NH2 dont les groupements
aminés représentent la source
d’azote.
-
Le Phosphore et le Soufre
: Ils occupent une place de
choix.
● Phosphore
: Il entre dans la composition des acides
nucléiques,
de
nombreux coenzymes et de
l’ATP.
Il est incorporé dans la bactérie sous forme de
Phosphate
inorganique.
Il permet la
récupération,
l’accumulation et la distribution
de l’énergie
dans la
cellule.
● Soufre
: Il entre dans la composition des acides
aminés,
des
Protéines
(groupement
thiol).
Il est incorporé dans la cellule sous
forme de
sulfate,
de composés soufrés
organiques,
rarement sous
forme de soufre réduit.
-
L’O2 et l’H2
: sont apportés par l’eau et par l’air
atmosphérique.
Les éléments ci
tés doivent être apportés en
quantités suffisantes.

3
-
En plus faible quantité sont apportés les éléments
minéraux.
●
Certains
interviennent dans l’équilibre physico
-
chimique de la
cellule
: Na ,K , Mg et Cl.
● D’autres constituent les enzymes ou les coenzymes
: Fer des
Cytochromes.
-
A l’état de
traces,
souvent apportés par l’eau
:
Ce sont les
les oligo
-
éléments car ils sont indispensables en quantité infime
:
Ce sont Ca , Mg , Co , Cu , Mn….
A noter que de nombreux ions métalliques peuvent être toxiques pour
certaines cellules
(
ex
: les sels
de cui
vre)
alors que d’autres ions sont
indispensables à des concentrations précises , soit pour la synthèse d’un
métabolite
(
ex
: 0.14 mg de Fe/l pour la synthèse de la toxine di
phtér
ique
)
, soit
pour la synthèse de
pigment
(
ex
: Fer+Magnésium pour la production de
Prodigiosine chez
Serratia marcescens
)
.
1
-
b
-
.Besoin
s énergétiques
Ils couvrent les dépenses engagées dans les processus de biosynthèses.
Les bactéries peuvent utiliser comme source d'énergie
:
-
soit l'énergie lumineuse (bactéries phot
otrophes),qui transforment les photons
lumineux en liaison ADP~Pi
-
soit l'énergie fournie par les processus d'oxydo
-
réduction (bactéries chimiotrophes).
Bactéries Phototrophes Bactéries Chimiotrophes
Elles utilisent un substrat oxydable minéral Elles puisent leur énergie au niveau de
ou organique , comme source d’électrons. réaction REDOX , couplant une réaction
d’oxydation d’un substrat SH2 à une réaction
h
γ de r
éduction .L’énergie est fabriquée au cours
SH2 de ces réactions REDOX par Phosphorylation.
ADP + Pi On distingue 2 types de Phosphorylation
:
NAD
NADH + H
+
-
Phosphorylation au niveau du substrat
:
ATP A AH2
S
ADP + Pi
ATP
E
SH2
SH2 S
-
Phosphorylation oxydative
:
SH2 minéral SH2 organique
B. pho
tolithotrophe B.photoorganotrophe
SH2 S
2H
+
+ 2e
-
A
chaîne de transport
AH2
ATP ATP
SH2
SH2 minéral SH2 organique
B. chimiolithotrophe B. chimioorganotrophe

4
Les bactéries
phototrophes
font appel à des composés minéraux ou organiques comme sources
d'électrons.
Si le substrat oxydable est minéral, la bactérie est dite
photolithotrophe :
elle est capable de se
développer dans un milieu purement minéral comme le font les végét
aux :exemple les bactéries
sulfureuses pourpres ou vertes.
Si le substrat oxydable est organique, la bactérie est dite
photoorganotrophe
:
exemple les bactéries
pourpres non sulfureuses.
Les bactéries
chimiotrophes
,qui puisent leur énergie à partir de ré
actions redox ,utilisent des composés
minéraux ou organiques comme "donneurs d’hydrogène ou d’électrons" ou "accepteurs d'électrons".
Si le donneur d’électron est un corps minéral, la bactérie est dite
chimiolithotrophe
, exemple bactérie
oxydant l’hydrogèn
e .
Si le composé est organique , la bactérie est dite
chimioorganotrophe.
La grande majorité des bactéries font partie de cette dernière catégorie: bactéries pathogènes d’intérêt
médical, de contamination alimentaire, d'usage industriel pour la synthèse d
'antibiotique de vitamines...
2. Des besoins spécifiques:
Ce sont des métabolites essentiels que la bactérie n’est pas en mesure de synthétiser par défaut
enzymatique et qu’il faut donc lui fournir pour permettre son développement.
On les appelle F
acteurs de croissance.
Les bactéries sont donc classées en 2 catégories
:
-
Les Prototrophes qui ne nécessitent pas de facteur de croissance (ex. E.coli)
-
Les Auxotrophes qui les exigent (ex. Haemophilus influenzae) .
Ex. Haemophilus influenzae exige 2 fa
cteurs de croissance
: facteur V ou NAD et facteur X ou
hémine.
Ces 2 facteurs sont présents dans la gélose au sang cuit , libérés par chauffage du sang .
Seul le facteur X est présent dans la gélose au sang frais car le facteur V est strictement intra
-
GR
et
n’est en gé
néral pas libéré dans le milieu
.
On cultive en strie , Staphylococcus aureus , qui libère dans le milieu du NAD synthétisé en excès et
Haemophilus influenzae pousse en satellitisme autour de la strie
: C’est le phénomène de
SYNTROPHIE.
Les f
acteurs de croissance peuvent appartenir à 3 classes
:
-
Les Acides aminés (pour la synthèse des Protéines)
-
Les bases puriques et pyrimidiques (pour la synthèse des acides nucléiques)
-
Les vitamines (comme Coenzym
es ou Précurseurs de Coenzyme)
Les besoins quantitatifs sont de l'ordre de 10 microgrammes pour la 1
ère
et la 2
ème
classe et de l'ordre de
1 microgramme pour la 3
ème
classe.
Les facteurs de croissance présentent des caractères communs
:
-
ils sont actifs à concentration infime
-
ils sont étroitement spécifiques c’est à dire qu’un simple changement de position d’un
groupement dans la molécule lui enlève toute son activité .
3
-
Les facteurs physiques
: Ils in
terviennent de façon primordiale dans l’obtention d’une culture
optimale .En effet , les nutriments doivent être apportés à la bactérie dans les conditions
d’environnement qui lui conviennent , sinon , ils peuvent l’inhiber.
a
-
Température
: Selon le comport
ement de la bactérie vis à vis de la température , on
distingue
:
les bactéries mésophiles
:dont la température optimale de croissance se situe entre 20°C
et 40°C .On admet généralement 30°C pour les mésophiles saprophytes , 37°C pour les

5
mésophiles patho
gènes . La majorité des microorganismes de l’homme et de l’animal
sont des mésophiles
: Bactéries pathogènes , bactéries des cavités naturelles ou du
revêtement cutanéo
-
muqueux humain ….
Les bactéries thermophiles
: la température optimale est de 45°C à 65
°C , généralement
55°C. Ce sont les bactéries des sources thermales .ex. Bacillus et Clostridium.
Les bactéries psychrophiles
: dont la température optimale se situe autour de 0°C. Dans
cette catégorie , on peut situer les B.Psychrotrophes qui cultivent
abondamment aux
températures de réfrigération mais qui se multiplient encore plus à 10°C ou 20°C.Ces
bactéries contaminent souvent les produits laitiers , de même que les produits
biologiques (sang ou dérivés sanguins) conservés
à basse température .
ex .Ps
eudomonas
, Acinetobacter, Aeromonas.
Les bactéries cryophiles
: qui préfèrent des températures inférieures à 0°C
:Ce sont les
bactéries des océans et des glaciers.
b
-
Le pH
: Les bactéries préfèrent un pH neutre ou légèrement alcalin (7
–
7.5) mais les
limit
es sont très larges
:
-
E.coli cultive entre pH 4.4 et pH8
-
Lactobacilles exigent plutôt un pH bas , voisin de 6 ( L.acidophilus)
-
Vibrion se multiplie au pH optimal de 9
Pour éviter les brusques variations de pH dues aux modifications chimiques qui résult
ent de la
dégradation du substrat , on utilise des solutions tampons.
Les tampons phosphates (K2HPO4 et KH2PO4) sont les plus utilisés parce qu’ils permettent de garder
le pH dans une large zone autour de 7 , parcequ’ils ne sont pas toxiques et qu’ils rep
résentent une
source de phosphore.
c
-
L’Oxygène
: Se
lon le type respiratoire
, on distingue
:
les B .aérobies strictes
: ne peuvent vivre qu’en présence d’oxygène de l’air et tolèrent
des PO2 élevées. ex. BK , B.pyocyanique , culture uniquement en surface.
L
es B. anaérobies strictes
: ne supportent pas l’O2 qui leur est toxique ex. Bacteroides
fragilis . Culture uniquement au fond du tube.
Les B.aéro
-
anaérobies facultatives
:se développent aussi bien en présence qu’en absence
d’oxygène . Leur richesse enzym
atique leur permet d’utiliser l’O2 s’il est présent et
d’utiliser la voie fermentaire quand l’oxygène est absent. ex.
Entérobactéries
Les B. microaérophiles
: ne se reproduisent qu’en présence d’une faible tension
d’oxygène . ex.
Campylobacter
Les B. anaérobies aero
-
tolérants
: bien que tolérant l’oxygène , ils ne peuvent pas
l’utiliser et tirent leur énergie exclusivement de la fermentation. ex. Lactobacilles
d
-
Pression osmotique
: Grâce à une paroi spécifique des procaryotes ( M
uréine) qui leur
confère une rigidité et une résistance aux chocs , les bactéries tolèrent des variations de
concentrations ioniques .
Certaines bactéries tolèrent des concentrations salines importantes ex. Enterococcus
(6.5% Nacl) Staphyloco
ccus aureus ( 7.5%Nacl)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%