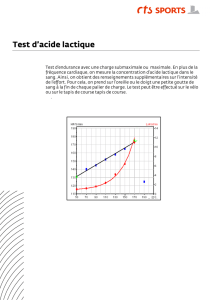
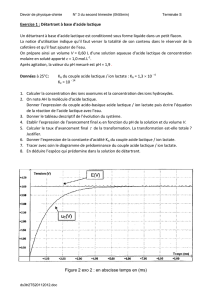
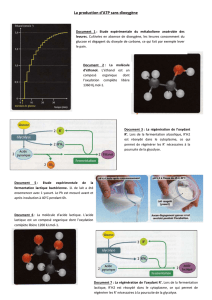
Exercice 1 Du lait au yaourt (6pts)

Terminale S – Partie b : Comprendre : Réaction avec échange de protons.
DU LAIT, DE L’ACIDE ACTIQUE ET DU YAOURT
Le lait est un produit biologique fragile. L’homme a su
exploiter la tendance qu’ont ses composants à se séparer afin de le conserver. Pour faire du beurre, on
recueille la matière grasse mais pour obtenir du fromage ou du yaourt, on attend que les protéines du lait
coagulent.
L’acide lactique est l’un des composants essentiels du lait.
Données :
Formule semi-développée de l’acide lactique :
Masse molaire de l’acide lactique : M = 90 g.mol-1
pKa (acide lactique/ion lactate) = 3,9
La phénolphtaléine est un indicateur coloré ; couple acide/base de pKa = 8,2 dont la forme acide est
incolore et la forme basique rose.
Questions.
1. Recopier la formule de l’acide lactique, entourer les groupes caractéristiques et justifier son nom dans
la nomenclature officielle : acide 2-hydroxypropanoïque.
2. Pourquoi l’acide lactique peut-il être considéré comme une base selon Bronsted ?
3. Donner la formule semi-développée de l’ion lactate, base conjuguée de l’acide lactique.
4. La mesure au laboratoire du pH d’une solution d’acide lactique de concentration c égale à 1,010-2
mol.L-1 donne pH = 2,9. L’acide lactique est-il un acide fort ou faible ?
5. Ecrire l’équation de mise en solution dans l’eau de l’acide lactique.
6. Donner l’expression de la constante d’acidité Ka du couple acide lactique / ion lactate.
7. Calculer la concentration en ions oxonium dans la solution.
8. En déduire la concentration en ions hydroxyde.
9. À partir des résultats expérimentaux précédents, calculer la valeur de la constante Ka du couple de
l’acide lactique, puis celle de son pKa.
10. Quelle peut être la cause du léger écart observé avec la valeur donnée dans le texte ?
11. Le pH d’un lait frais se situe autour de 6,5. Indiquer à l’aide d’un diagramme de prédominance quelle
est l’espèce prédominante du couple acide lactique/ion lactate ?
12. On rajoute au lait quelques gouttes de phénophtaléine. Quelle sera la couleur de la solution ?
13. On s’intéresse au spectre RMN de l’acide lactique. Combien y aura-t-il de groupes de signaux ?
14. Interpréter la multiplicité des signaux.
15. On désire diluer la solution vingt fois. Indiquer comment faire si on veut réaliser 200,0 mL de solution.
16. Le pH de la solution sera-t-il plus petit ou plus grand ?

Terminale S – Partie b : Comprendre : Réaction avec échange de protons.
Correction : DU LAIT, DE L’ACIDE ACTIQUE ET DU YAOURT
1. Recopier la formule de l’acide lactique, entourer les groupes caractéristiques et justifier son nom dans
la nomenclature officielle : acide 2-hydroxypropanoïque.
Sur la formule de l’acide lactique, on reconnaît :
- une chaîne principale de 3 atomes de carbone d’où « propan »
- un groupe carboxyle caractéristique des acides carboxyliques d’où « acide » et « oïque »
- un groupe hydroxyle caractéristique des alcools en position 2 d’où « 2-hydroxy »
2. Pourquoi l’acide lactique peut-il être considéré comme une base selon Bronsted ?
Au sens de Bronsted, un acide est une substance capable de perdre un proton H+. L’acide lactique peut perdre
un ion H+ pour donner sa base conjuguée
3. Donner la formule semi-développée de l’ion lactate, base conjuguée de l’acide lactique.
4. La mesure au laboratoire du pH d’une solution d’acide lactique de concentration c égale à 1,0
10-2
mol.L-1 donne pH = 2,9. L’acide lactique est-il un acide fort ou faible ?
Si l’acide lactique était un acide fort, on pourrait écrire pH = – log c avec c concentration molaire en acide
lactique apporté donc on aurait pH = – log (1,5×10–3) = 2,8.
Or le pH étant égal à 3,4, l’acide lactique ne s’est pas entièrement dissocié dans l’eau : c’est un acide faible (Il
s’est formé moins d’ions oxonium que si l’acide était fort).
5. Ecrire l’équation de mise en solution dans l’eau de l’acide lactique.
L’acide lactique est noté HA et sa base conjuguée A– : HA(aq) + H2O(l) = A–(aq) + H3O+
6. Donner l’expression de la constante d’acidité Ka du couple acide lactique / ion lactate.
Ka =
( ) 3
()
A . H O
HA
aq ff
aq f
7. Calculer la concentration en ions oxonium dans la solution.
[H3O+] = 10–pH donc [H3O+]f = 10–2,9 = 1,310–3 mol.L–1
8. En déduire la concentration en ions hydroxyde.
Produit ionique de l’eau : [H3O+]× [HO-] = 10-14 donc [HO-] = 10-14 / [H3O+] = 10-11,9 = 1,26.10-12 mol/L
9. À partir des résultats expérimentaux précédents, calculer la valeur de la constante Ka du couple de
l’acide lactique, puis celle de son pKa.
Ka =
( ) 3
()
A . H O
HA
aq ff
aq f
D’après la conservation de la matière [HA(aq)]f = c – [A–(aq)]f
De plus d’après l’équation chimique [H3O+]f = [A–(aq)]f
alors Ka =
2
3
3
HO
c H O
f
f
=
2.
10
c 10
pH
pH
=
2 2,9
2 2,9
10
1,0 10 10
= 1,810–4
pKa = – log Ka donc pKa = 3,7
10. Quelle peut être la cause du léger écart observé avec la valeur donnée dans le texte ?
Le texte indique pKa = 3,8. Le léger écart est dû au manque de précision du pH-mètre. Le pHmètre peut être
mal étalonné.
hydroxyle
carboxyle
*

Terminale S – Partie b : Comprendre : Réaction avec échange de protons.
11. Le pH d’un lait frais se situe autour de 6,5. Indiquer à l’aide d’un diagramme de prédominance quelle
est l’espèce prédominante du couple acide lactique/ion lactate ?
Le pH du lait frais étant supérieur à (pKA +1) du couple acide lactique/ion lactate, c’est l’ion lactate qui
prédomine dans le lait frais.
12. On rajoute au lait quelques gouttes de phénophtaléine. Quelle sera la couleur de la solution ?
Le pH du lait frais étant inférieur à (pKA-1) du couple acide/base de l’indicateur coloré, l’espèce qui prédomine
est l’acide de l’indicateur donc la solution sera incolore.
Forme acide forme basique
pH ≈ 6,5 7,2 pKa = 8,2 9,2
13. On s’intéresse au spectre RMN de l’acide lactique. Combien y aura-t-il de groupes de signaux ?
Il y aura autant de signaux que de groupe d’hydrogènes identiques, c'est-à-dire 4.
14. Interpréter la multiplicité des signaux.
Les 2 hydrogènes des –Oh donneront chacun un singulet du fait de la liaison avec l’oxygène.
Les 3 hydrogènes sont liés à un hydrogène, cela donnera un doublet.
L’hydrogène du carbone du milieu est lié à 3 hydrogènes, cela donnera un quadruplet.
15. On désire diluer la solution vingt fois. Indiquer comment faire si on veut réaliser 200,0 mL de solution.
Une dilution de 20, cela veut dire F=20= Vf/Vm donc vm = Vf/20 = 200/20 = 10,0 mL
Il faut rincer et conditionner une pipette de 10,0 mL.
Pipeter la solution et l’introduire dans une fiole de 200,0 ml préalablement rincée à l’eau.
Ajouter de l’eau à moitié et mélanger.
Ajouter de l’eau et ajuster au trait de jauge. Homogénéiser.
16. Le pH de la solution sera-t-il plus petit ou plus grand ?
La solution est plus diluée, il y aura donc moins d’ions oxonium (concentration plus faible), donc le pH sera
plus élevé.
pH ≈ 6,5
pH
pKA = 3,9 4,9
Acide lactique
Ion lactate
1
/
3
100%