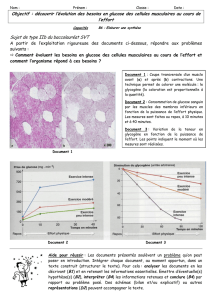
L`expérience de la bouteille bleue

Chimie – Terminale S
Chapitre 1
Exercice
L’expérience de la bouteille bleue
Une vidéo de l’expérience : http://scienceamusante.net/wiki/index.php?title=La_bouteille_bleue
La préparation de cette expérience est facile : il suffit de mettre dans un flacon de 500 mL, 250,0 mL de
solution de soude à 1,0 mol.L–1 et 10,00 g de glucose. Après dissolution du glucose, ajouter 0,5 mL de
solution alcoolique de bleu de méthylène à 0,1 %.
Le flacon étant bouché et au repos, la solution est incolore.
En agitant le flacon, la solution bleuit immédiatement, puis se redécolore peu à peu.
L’expérience peut être répétée plusieurs fois.
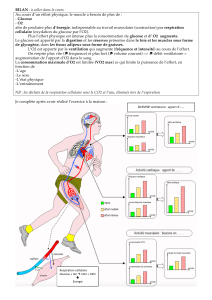
La formule du bleu de méthylène, sous sa forme oxydante, est la suivante. On la représentera par (B2+(aq)
+ 2 Cl–(aq)) ; c’est l’ion B2+ qui donne lieu à des réactions d’oxydoréduction.
1 – Préparation de l’expérience
La soude est une solution aqueuse d’hydroxyde de sodium, espèce commercialisée sous la forme de
cristaux dans des flacons portant les indications
masse molaire : 40,00 g.mol–1
corrosif
dangereux pour la peau et les yeux
1. Quelles précautions doit-on prendre pour manipuler la soude ?
2. Quelle masse d’hydroxyde de sodium doit-on peser pour préparer 250,0 mL de solution de
soude à 1,0 mol.L–1 ?
3. Quel récipient faut-il utiliser pour préparer 250,0 mL de solution ?
4. Décrire les étapes de l’opération de dissolution.
2 – Pourquoi la solution bleuit-elle ?
Le bleu de méthylène est un indicateur redox, bleu quand il est sous forme oxydée et incolore sous sa
forme réduite.
1. Quand on agite le flacon, l’oxydant qui intervient est le dioxygène de l’air. Proposer des
expériences permettant de vérifier cela.
2. La solution est basique. Quelle est l’espèce chimique responsable de cela ?
3. En milieu basique, le dioxygène est l’oxydant du couple O2(g)/HO–(aq). Ecrire la demi-équation
électronique relative à ce couple.
4. Les formes oxydée et réduite du bleu de méthylène sont respectivement notées B2+ et BH3+. Ecrire
la demi-équation correspondant à ce couple en milieu basique.
5. Cette réaction est-elle rapide ou lente ?
3 – Pourquoi la solution bleue se décolore-t-elle ?
1. Le glucose a pour formule CH2OH – (CHOH)4– CHO. Quels groupes caractéristiques possède
cette molécule ? Préciser éventuellement la classe.
N
S N+
HN+
CH3
CH3
CH3
CH3

Chimie – Terminale S
Chapitre 1
Exercice
2. Dans les conditions de la réaction, le glucose (qu’on notera R–CHO pour simplifier) s’oxyde en
ion gluconate, R–COO–.
a. Pourquoi ne se forme-t-il pas l’acide gluconique R–COOH ?
b. Ecrire la demi-équation électronique relative au couple R–COO–/R–CHO en milieu
basique.
c. Ecrire l’équation de la réaction de réduction par le glucose du bleu de méthylène oxydé.
d. Cette réaction est-elle rapide ou lente ?
4 – L’expérience peut-elle être poursuivie indéfiniment ?
1. En combinant les équations écrites en 1.4 et en 4.2.c, montrer que le bleu de méthylène n’est pas
consommé et que les réactifs sont le dioxygène, le glucose et les ions hydroxyde.
2. a. Le volume d’air dans le flacon est de 250 mL. En considérant que le volume molaire des gaz est
de 24,0 L.mol–1 dans les conditions de l’expérience, calculer la quantité de matière initiale de
dioxygène.
b. Calculer la quantité de matière initiale en glucose.
c. Calculer la quantité de matière initiale en ions hydroxyde.
d. A l’aide d’un tableau d’avancement, indiquer quel est le réactif limitant.
3. L’expérience ne réussit pas si l’on met trop de bleu de méthylène. Pourquoi ?
Données : masse molaire du glucose : 180 g.mol–1.
1
/
2
100%