Télécharger le poster

Bilan pré-thérapeutique de
la carcinose péritonéale des
cancers de l'ovaire.
Qu'attend le chirurgien ?
W Hajlaoui, LS Fournier, C Bensaid, M Brisa, C Lefort, F Lecuru, G Frija
Hôpital Européen Georges Pompidou. Paris, France
JFR 2008

INTRODUCTION
5ème cancer de la femme et 3ème cause de décès par cancer
La survie à 5 ans tous stades confondus est de 35%
Le pronostic dépend essentiellement du stade initial et 70 % découvert à un
stade avancé avec carcinose
La prise en charge repose, en plus d’un traitement standard, sur une chirurgie
de réduction tumorale des localisations péritonéales.
La chasse aux implants péritonéaux par cœlioscopie est une aventure difficile,
délicate et limitée, d’où la nécessité d’une exploration préthérapeutique pour
orienter ce geste ; d’autant plus que la cœlioscopie sous-estime la
dissémination dans 30 % des cas.
En effet, le scanner multicoupe se distingue comme un outil performant
permettant la
détection
de la carcinose, d’en préciser la
cartographie
et par
conséquent de prévoir les difficultés chirurgicales et avancer un
staging
préliminaire pouvant poser les contres-indications à une exérèse optimale.
Les autres moyens d’exploration viendront en complément.

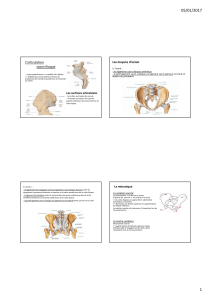
ANATOMIE ET PHYSIOLOGIE DU
PERITOINE
Définitions:
Les cavités péritonéales:
A – Cavité sus-mésocolique
Les ligaments
Les espaces
B – Cavité sous-mésocolique
Les replis
Les espaces

Définitions:
•Péritoine : séreuse millimétrique, organisée en deux feuillets
pariétal et viscéral, recouvrant la majorité des organes intra-
abdominaux et présentant de nombreuses réflexions.
•La cavité péritonéale est une cavité virtuelle contenant 1 à 2 ml
de liquide (40 ml chez la femme).
•C’est un lieu d’échange avec le milieu sanguin, joue un rôle
immunitaire et permet le glissement des viscères.

Méso : zone de réflexion du
péritoine viscéral contenant
la vascularisation de
l’organe.
Ligament : pas de
vascularisation.
Epiploon / Omentum: bord
libre ne contenant pas un
organe.
Le mésocôlon transverse
partage la cavité
péritonéale en étages sus-
mésocolique et sous-
mésocolique. D’après Netter
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
1
/
61
100%