Concours IFTLM_sujet chimie 2012

Page 1 sur 3
INSTITUT DE FORMATION DE
TECHNICIENS DE LABORATOIRE MEDICAL (IFTLM)
CONCOURS D’ENTREE Vendredi 11 Mai 2012
CALCULATRICES NON PROGRAMMABLES AUTORISEES
Le sujet comporte 3 pages dont une (page 3) est à rendre avec la copie.
EPREUVE DE CHIMIE
DUREE : 1 heure
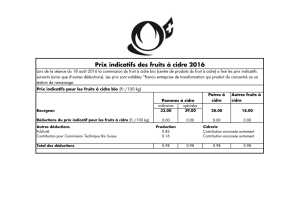
Le vinaigre de cidre :
Il est obtenu par la fermentation acétique du cidre de pommes. Ses propriétés
thérapeutiques sont reconnues depuis l’antiquité ; les médecins grecs le
prescrivaient en mélange avec le miel et l’eau sous le nom d’Oxymel.
Dans cet exercice nous proposons de faire le dosage d’un vinaigre de cidre
commercial par pH- métrie.
Le cidre contient naturellement plusieurs acides présents en faible quantité qui contribuent au
mélange des goûts de la boisson : sucré, amer et acide. Ce sont les acides malique, lactique,
citrique et acétique (ou éthanoïque).
L’oxydation de l’éthanol, alcool principal du cidre, produit une grande quantité d’acide
éthanoïque (fermentation acétique); c’est cet acide qui sera dosé dans cet exercice.
I – Première partie : les groupes fonctionnels (5 points):
3 – Écrire l’équation bilan général de la formation d’une molécule comportant le groupe
fonctionnel de la question 2 à partir de deux molécules distinctes comportant chacune l’un des
deux groupes fonctionnels de la question 1. (Utiliser R
1
et R
2
pour représenter les chaines
carbonées, appelées aussi groupes alkyles). Quel est le nom donné à cette réaction ?
1 - L’acide malique comporte deux groupes
fonctionnels différents ; copier la formule semi
développée ci contre et entourer les groupes
fonctionnels en les nommant.
2 – L’oxydation du cidre produit de l’acétoacétate
qui semble donner à la boisson ses qualités
thérapeutiques. La molécule est représentée ci
contre ; copier sa formule semi développée et
entourer le groupe fonctionnel caractéristique en le
nommant.

Page 2 sur 3
II – Le dosage (15 points) :
Données
:
L’acide éthanoïque (CH
3
COOH) est un acide carboxylique faible ; sa masse
molaire moléculaire : M = 60 g.moL
-1
.
À 25°C : pK
A
(acide éthanoïque/ion éthanoate) = 4,8. Pour le produit ionique de l’eau : pKe
= 14.
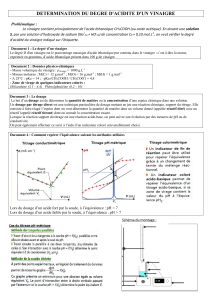
Le suivi de la réaction est fait à la fois par pH métrie et à l’aide d’un indicateur coloré. On
dispose de trois indicateurs :
Indicateur coloré Zone de virage
Hélianthine
Bleu de bromothymol
Phénolphtaléïne
Rouge 3,2 – 4,4 Jaune
Jaune 6,0 – 7,6 bleu
Incolore 8,2 -10,0 rose
La solution acide est dosée par une solution basique d’hydroxyde de sodium (Na
+
+ HO
-
) de
concentration molaire égale à 1,0×10
-2
mol.L
-1
.
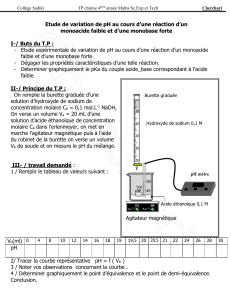
1 - Faire un schéma annoté du montage de dosage en précisant le nom du matériel et de
l’appareillage utilisé et les emplacements de la solution titrée et de la solution titrante.
2 - Écrire l’équation de la réaction qui se produit entre la solution d’acide éthanoïque et la
solution d’hydroxyde de sodium.
3 – Afin de démontrer que cette réaction est totale, on se propose de calculer sa constante Kr.
a) Écrire l’expression de la constante d’équilibre de la réaction de dosage Kr.
b) Écrire l’expression de la constante d’acidité de l’acide éthanoïque K
A
.
c) Écrire le produit ionique de l’eau Ke.
d) Exprimer le rapport K
A
/Ke et en déduire la valeur de Kr.
e) La réaction est elle totale ? Dire pourquoi.
La solution commerciale de cidre, S
0
, est très concentrée par rapport à la solution
d’hydroxyde de sodium ; elle est diluée 100 fois. La solution diluée, sur laquelle est effectuée
le dosage , est notée S.
À l’aide du dipositif expérimental on effectue le dosage de 10 mL de vinaigre dilué S à l’aide
de la solution de soude mentionnée ci-dessus. La courbe pH métrique obtenue est montrée en
annexe 1 (à rendre avec la copie).
4 – Déterminer les coordonnées du point d’équivalvence à l’aide d’une méthode graphique en
expliquant votre démarche.
5 – Dire brièvement à quoi correspond l’équivalence dans une réaction de dosage.
6 – Calculer la concentration de la solution S et en déduire celle de la solution commerciale
S
0
.
7 – L’étiquette du vinaigre commercial indique que le produit est à 5°, soit 5 g d’acide pour
100 mL de vinaigre. Vérifier cet étiquetage à l’aide des résultats précédents.
8 – Sur les trois indicateurs disponibles, lequel convient le mieux pour déterminer le point
d’équivalence? Expliquer pourquoi.

Page 3 sur 3
ANNEXE 1 : à rendre avec la copie
1
/
3
100%