BAC BLANC N°2 E8 Sciences de la matière

BAC BLANC N°2 E8
Sciences de la matière
coefficient : 2 – Durée : 2 h
PHYSIQUE Étude du mouvement d’une automobile ( 10 points)
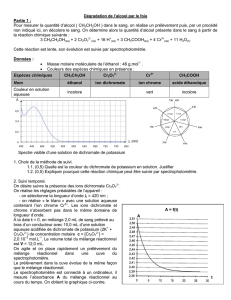
Un automobiliste laisse son véhicule de masse m = 1100 kg en stationnement au sommet A d’une côte
de longueur AC = 500 m faisant un angle α = 7,5° avec l’horizontale.
Cette situation est illustrée sur la figure n°1 de l’annexe. Ce document est à rendre avec la copie.
Remarque : pour des raisons de commodité, l’angle
α
a été fortement augmenté sur les figures 1 et 2 du
document.
1. Donner les quatre caractéristiques du vecteur
P
(poids du véhicule).
On donne la valeur de l’intensité de la pesanteur : g = 9,8 N.kg-1
2. On admet qu’en stationnement le véhicule est soumis aux trois forces suivantes :
•
P
: poids du véhicule ;
•
N
R
: réaction normale de la route ;
•
f
: force d’opposition à la mise en mouvement du véhicule.
2.1. Écrire la relation qu’il existe entre ces 3 vecteurs forces.
2.2. Représenter sur la figure 1 de l’annexe ces trois forces au centre de gravité G du véhicule, sans
souci d’échelle, mais en respectant la relation écrite en 2.1.
2.3. Déterminer par le calcul l’intensité des forces
N
R
et
f
.
3. Le conducteur desserre le frein à main du véhicule. Au point mort (c’est à dire le moteur n’ayant
aucune prise), l’automobile se met en mouvement et descend la côte (figure 2 du document). On
prend le bas de la côte (point C) comme référence pour le calcul des énergies potentielles.
3.1. Calculer l’énergie potentielle EP du véhicule aux points A, B et C.
3.2. Dans un premier temps, on fait l’hypothèse que les frottements sont négligeables. Déterminer
l’énergie cinétique EC du véhicule aux points A, B et C.
3.3. En déduire les valeurs théoriques de la vitesse v aux points B et C.
3.4. La vitesse réelle au point C est v’C = 65 km.h-1. Déterminer l’énergie dissipée par les frottements
au cours de la descente.
4. On étudie le mouvement d’une roue de la voiture au point C. On considère les roues et les pneus
comme circulaires (voir la figure 3). La vitesse de la voiture est alors celle donnée dans la question
précédente.
4.1. Donner la vitesse linéaire v d’un point de la périphérie d’un pneu ; en déduire la période T, la
fréquence de rotation f et la vitesse angulaire ω d’une roue.
4.2. Calculer la vitesse vD d’un boulon de la roue.
4.3. Un gravillon reste bloqué dans une rainure d’un pneu ; il subit une accélération de valeur a.
Donner l’expression littérale de a en fonction de la vitesse v du pneu et du rayon R de la roue.
Vérifier cette expression littérale par un calcul d’unités. Calculer a.

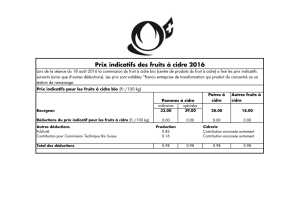
CHIMIE Dosage d’un cidre ( 10 points)
Le cidre peut être considéré comme une solution aqueuse d’éthanol, molécule de formule brute C2H6O.
Par action de l’ion dichromate
−2
72OCr
en milieu acide, l’éthanol est transformé en acide éthanoïque.
Les couples intervenant dans cette réaction ont les caractéristiques suivantes :
COUPLE
+−32
72 CrOCr
C2H4O2 / C2H6O
POTENTIEL REDOX E° (V)
1,33
0,04
COULEURS DES ESPECES
Orange / vert
Incolore / incolore
1. Donner les formules semi-développées de l’éthanol et de l’acide éthanoïque.
2. Dans ces deux couples, indiquer l’oxydant le plus fort et le réducteur le plus fort.
3. On donne les équations des demi-réactions correspondant à ces deux couples :
…
−2
72OCr
+ … H+ + … e- … Cr3+ + ... H2O
C2H4O2 + … H+ + … e- C2H6O + ... H2O
3.1. Ajuster les coefficients stœchiométriques de ces équations.
3.2. Déduire l’équation de la réaction du dosage.
On dose l’éthanol, de concentration C0 inconnue, contenu dans ce cidre.
Pour cela on prélève un volume V0 = 10,0 mL de cidre. On acidifie le milieu réactionnel par l’ajout de 1 mL
d’acide sulfurique concentré. On ajoute goutte à goutte une solution de dichromate de potassium de
concentration C = 0,500 mol.L-1 sous agitation magnétique.
On acidifie fortement le cidre par quelques mL d’acide sulfurique concentré avant de procéder au dosage.
On verse le volume Véq = 28,6 mL de solution de dichromate de potassium pour obtenir l’équivalence.
4. Faire un schéma légendé du dispositif de dosage.
5. Donner en justifiant l’espèce chimique qui constitue l’indicateur coloré de ce dosage.
6. Détermination de C0 :
6.1. Donner la relation à l’équivalence.
6.2. Déduire que C0 = 2,145 mol.L-1.
7. La définition du degré alcoolique d’une boisson est la suivante : le « degré alcoolique » d’un cidre
ou d’un vin est le volume d’éthanol (donné en mL) contenu dans 100 mL de cidre ou de vin.
7.1. Déterminer la masse m d’éthanol contenue dans 100 mL de cidre.
7.2. Calculer le degré alcoolique de ce cidre.
8. L’éthanol peut réagir avec l’acide éthanoïque au cours d’une réaction appelée estérification. Un
des produits formés est l’éthanoate d’éthyle.
8.1. Indiquer les principales propriétés de cette réaction.
8.2. Expliquer pourquoi cette réaction n’est pas à craindre au cours du dosage.
Données :
- Masse volumique de l’éthanol :
ρ
= 790 g.L-1;
- masses molaires atomiques (en g.mol-1) : H : 1,0 C : 12,0 O : 16,0

Annexe
(à compléter et à rendre avec la copie)
+ G
Figure 1
α
•
A
•
C
•
B
Figure 2
α
AC = 500 m
AB = 250 m
Diamètre d’un pneu :
D1 = 60 cm
Boulons ;
Distance à l’axe :
R2 = 5 cm
Figure 3
(Schéma d’une roue)
pneu
Axe de rotation de
la roue
1
/
3
100%