D.S.T. N° 3

CLASSE DE PREMIÈRE S
Le : 11 janvier 2012
Durée : 2 h 00
Physique-Chimie
DEVOIR SUR TABLE N° 3
TOUT DOCUMENT INTERDIT.
L’usage de calculatrices scientifiques à mémoire est autorisé.
Les résultats numériques doivent être précédés d’un calcul littéral.
La présentation et la rédaction font partie du sujet et interviennent dans la notation.
L’épreuve est notée sur 16 points auxquels s’ajouteront les points d’épreuve pratique sur 4 points.
I ] EXERCICE 1 : sur 4,25 points.
IMAGE D’UN OBJET
IMAGE D’UN OBJETIMAGE D’UN OBJET
IMAGE D’UN OBJET RÉ
RÉ RÉ
RÉE
EE
EL
LL
L
Une lentille mince convergente (L), de centre optique O et de diamètre 5,00 cm, porte l’indication « + 25
δ
».
Un objet réel AB, de 2,00 cm de haut, est situé à 9,00 cm de la lentille.
AB est perpendiculaire à l’axe optique principal de la lentille et A est situé sur cet axe.
1. Qu’est-ce qu’un point objet réel ?
2. Donner la définition de la vergence d’une lentille. Quelle est son unité ? En déduire la valeur de la distance focale de (L).
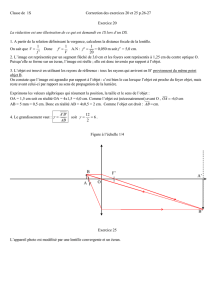
3. 3.1. Sur un schéma, tracé sur le papier millimétré fourni en ANNEXE page 3 (à rendre avec la copie en indiquant
son nom), aux échelles 1, horizontalement et verticalement, représenter (L), l'objet AB et l'image A'B'. Expliquer le tracé.
3.2. Déduire, par lecture sur le schéma, les valeurs de OA' et de
A
'B' .
3.3. Tracer la marche d’un faisceau de lumière issu de B qui s’appuie sur les contours de la lentille (L). Justifier le tracé.
4. Retrouver, par le calcul, les valeurs de OA' et de
A
'B' .
5. Déterminer la valeur du grandissement de ce système optique. Proposer une conclusion.
II ] EXERCICE 2 : sur 5,00 points.
SUIVI D’UNE TRANSFOR
SUIVI D’UNE TRANSFORSUIVI D’UNE TRANSFOR
SUIVI D’UNE TRANSFORMATION CHIMIQUE
MATION CHIMIQUEMATION CHIMIQUE
MATION CHIMIQUE
On se propose d'étudier la transformation lente de décomposition de l'eau oxygénée, H2O2, par les ions iodure en
présence d'acide sulfurique en excès (ions H+(aq)). L'équation de la réaction qui modélise cette transformation s'écrit :
H2O2 (aq) + 2 I–(aq) + 2 H+(aq) →
→→
→ I2 (aq) + 2 H2O(liq).
La solution de diiode formée étant colorée, la transformation est suivie par spectrophotométrie, méthode qui consiste
à mesurer l'absorbance A de la solution, grandeur proportionnelle à la concentration en diiode coloré.
1. Le spectre d'absorption d’une solution de diiode est donné ci-contre.
1.1. Interpréter la couleur de la solution de diiode.
1.2. À quelle longueur d'onde faut-il régler le spectrophotomètre ?
Pour quelle raison ?
2. À la date t = 0 s, on mélange un volume V1 = 20,0 mL d'une solution
d'iodure de potassium, de concentration apportée c1 = 0,100 mol.L-1,
acidifiée avec de l'acide sulfurique en excès, un volume V2 = 2,00 mL d’une solution d'eau oxygénée, de concentration
apportée c2 = 0,100 mol.L-1, et un volume V3 = 8,00 mL d'eau distillée. On obtient la solution (S). On remplit une cuve
spectrophotométrique avec cette solution, et on relève les valeurs de son absorbance au cours du temps. On détermine
alors, grâce à la loi de Beer-Lambert, la concentration molaire c(I2) du diiode formé au cours du temps.
t (en s) 0 126 434 682 930 1 178 1 420
c(I2) (en mmol.L-1)0,00 1,74 4,06 5,16 5,84 6,26 6,53
2.1. Exprimer la loi de Beer-Lambert, en précisant la signification et les unités des grandeurs intervenant dans cette
expression.
2.2. Le mélange initial est-il stœchiométrique ?
2.3. Établir le tableau descriptif de l'évolution du système chimique.
2.4. Établir la relation entre c(I2) et l'avancement x de la réaction.
2.5. Déterminer l'avancement maximal de la réaction.
2.6. En déduire la valeur théorique de la concentration en diiode formé
dans le milieu réactionnel lorsque la transformation est terminée.
3. La courbe ci-contre représente les variations de l'avancement x de la
réaction en fonction du temps.
Donner la composition du mélange réactionnel pour t = 310 s.
... /
...

III ] EXERCICE 3 : sur 3,00 points.
COULEURS DES POLYÈNE
COULEURS DES POLYÈNECOULEURS DES POLYÈNE
COULEURS DES POLYÈNES
SS
S
Les polyènes linéaires sont des molécules organiques linéaires possédant un squelette carboné présentant une
alternance de simples et doubles liaisons carbone-carbone.
1. Donner les formules topologiques des polyènes comportant 3, 5 et 7 atomes de carbone.
2. Chaque polyène passe d'un niveau fondamental E0 d'énergie moléculaire à un niveau d'énergie excité E1 par absorption
d'une radiation lumineuse de longueur d'onde λ. Le diagramme ci-dessous représente l'écart d'énergie ∆E = E1 – E0 mesuré
en fonction du nombre n de doubles liaisons conjuguées du polyène.
2.1. Comment varie qualitativement l'écart d'énergie ∆E lorsque le nombre n de doubles liaisons conjuguées
augmente ?
2.2. En déduire qualitativement comment varie la valeur λ de la longueur d'onde d'absorption.
3. Pour n = 5, on mesure : ∆E5 = 3,72 eV. Pour n = 11, on mesure : ∆E11 = 2,64 eV.
3.1. Dans chacun des deux cas, calculer la longueur d'onde λ d'absorption maximale.
3.2. Quelle est la couleur due à ces deux polyènes ? Justifier la réponse.
Données : Constante de Planck : h = 6,63.10-34 J.s ; célérité de la lumière : c = 3,00.108 m.s-1; 1 eV = 1,60.10-19 J.
IV ] EXERCICE 4 : sur 3,75 points.
LE PROJET I.T.E.R.
LE PROJET I.T.E.R.LE PROJET I.T.E.R.
LE PROJET I.T.E.R.
La fusion nucléaire étudiée dans le réacteur international expérimental I.T.E.R. (« International Thermonuclear
Experimental Reactor » ou « Réacteur thermonucléaire expérimental international ») à Cadarache (Bouches du Rhône) met
en jeu les deux isotopes minoritaires de l'hydrogène. Un noyau de deutérium 2
1H et un noyau de tritium 3
1H fusionnent pour
former un noyau d'hélium 4
2He .
1. Écrire l'équation de cette fusion nucléaire, en précisant les lois de conservation utilisées.
2. La température du milieu (appelé plasma) doit être de l'ordre de 100 millions de degrés. Pourquoi une température si
élevée est-elle nécessaire ?
3. Donner les expressions de la variation de masse, puis de l'énergie libérée, au cours de la réaction de fusion.
4. Calculer la valeur de l'énergie libérée par la fusion en joule et en MeV.
5. Si le deutérium présent dans le réacteur peut être extrait de l'eau de mer, le tritium n'existe qu'en très petite quantité
sur Terre. Il peut cependant être fabriqué « in situ » dans le réacteur par bombardement neutronique du lithium 6 (Z = 3).
Écrire l'équation nucléaire de la transformation du lithium 6 en tritium. Nommer les noyaux formés.
D'où peuvent provenir les neutrons nécessaires ?
6. À la différence du deutérium, le tritium est radioactif β–. Écrire l'équation de sa désintégration radioactive et nommer
le noyau fils produit. De quel type de réaction nucléaire s’agit-il ?
Données :
Noyau ou particule 2
1H 3
1H 3
2He 4
2He neutron
Masse (en u) 2,013 55 3,015 50 3,014 93 4,001 51 1,008 66
1 u = 1,660 54.10-27 kg ; 1 eV = 1,602 18.10-19 J ; célérité de la lumière : c = 2,997 924 58.108 m.s-1
.../ p. 3

Première S Devoir sur Table N° 3 Page 3
ANNEXE MILLIMÉTRÉE
À rendre avec la copie en indiquant son NOM :
EXERCICE 1 : 3.1.
1
/
3
100%