Réhabilitation rapide en chirurgie digestive - Chirurgie

FCC19 Réhabilitation rapide en chirurgie digestive : les limites du fast tract
SOMMAIRE
« Fast track surgery 2010 » - nouveautés et controverses
M. HÜBNER
Que signifie la réalimentation précoce en chirurgie digestive?
C. MARIETTE
Impact de l’analgésie épidurale en chirurgie colique
E. FUTIER
Valeur de la chirurgie mini invasive dans l’amélioration du rétablissement
postopératoire
E. RULLIER

FCC19 Réhabilitation rapide en chirurgie digestive : les limites du fast tract
« FAST TRACK SURGERY 2010 » - NOUVEAUTES ET CONTROVERSES
Dr. Martin Hübner
Service de chirurgie viscérale
CHUV - Lausanne
Rue du Bugnon 46
CH-1011 Lausanne
tel.: +41 21 314 2418
e-mail: martin.hubner@chuv.ch
Abréviations:
Fast track – FT
Soins classiques - SC
Cet résumé ce base en partie à un article revue sur la réhabilitation rapide (1).

FCC19 Réhabilitation rapide en chirurgie digestive : les limites du fast tract
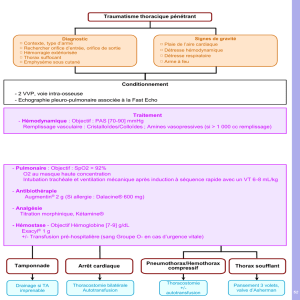
Introduction
Le concept Fast Track (FT), ou réhabilitation précoce (ERAS: enhanced recovery after surgery), a été introduit
par Kehlet et al. en 1995, dans le cadre de la chirurgie colique (2). Ils suggèrent que la combinaison entre la
chirurgie laparoscopique, l’analgésie péridurale, la réalimentation précoce et la mobilisation rapide des
patients permet de réduire la douleur et les différentes dysfonctions organiques induites par le stress
chirurgical. Par la suite, les mêmes auteurs ont développé un concept multimodal pour diminuer le temps
d’hospitalisation à 2-3 jours après la chirurgie colo-rectale ouverte (3, 4). L’objectif principal est de faciliter le
rétablissement et le confort des patients tout en diminuant la morbidité, la durée d’hospitalisation et les coûts
(5-7). Le taux de réadmission n'a pas été augmenté comparativement au programme de chirurgie classique (7,
8). Une première étude prospective et randomisée a récemment montré aussi une diminution du taux de
complications post opératoires chez les patients bénéficiant de ce type de programme FT (6). Tandis qu’un
nombre croissant de centres à travers le monde adoptent ce même programme FT, une majorité majorité reste
encore réticente, malgré les avantages que montre la littérature récente (9). Pa ailleurs, il est difficile de définir
précisément ce concept, car de nombreux éléments du FT font déjà partie de soins classiques (SC) (10) et c’est
l’ensemble des mesures qui vont déterminer le succès du FT, et non pas l’application isolée de l’une ou l’autre.
Le but de cette présentation est d’expliquer les principes et les facteurs clés de la chirurgie FT. Ses avantages,
ses limitations et son développement futur seront aussi discutés.
Qu’est que le concept Fast Tract
Plusieurs mesures péri-opératoires ont été proposées pour atteindre l’objectif FT. Les éléments importants
généralement acceptés sont une nouvelle prise en charge préopératoire avec notamment une diminution de la
durée du jeûne, l’absence de préparation colique et une diminution des apports liquidiens ainsi qu’une
analgésie péridurale thoracique, une réalimentation précoce et une rapide mobilisation des patients (7, 10).
Cependant, il est difficile d'évaluer l'impact de chaque mesure prise individuellement, en effet certaines
mesures offrent un bénéfice alors que d’autres n’ont qu’un effet marginal (7, 11). Actuellement, seule la
diminution des apports liquidiens péri-opératoires et l’analgésie péridurale ont démontré un bénéfice en terme
de diminution des complications (6). En se basant sur la littérature, on peut actuellement proposer les
éléments du Tableau 1 comme faisant partie intégrante de la chirurgie FT (10). Il est important de souligner
que le programme FT ne fonctionne que s´il y a une excellente collaboration conjointe du chirurgien, de
l’anesthésiste et d'une équipe infirmière formée. Néanmoins l'élément le plus important reste un patient
motivé et bien informé avant l'opération du programme de réhabilitation qu’ 'il suivra (5, 10). Pour garantir un
maximum de sécurité, certains critères doivent être respectés avant le retour à domicile des patients:
- les douleurs doivent être contrôlées par une antalgie simple
- le patient doit se réalimenter normalement
- le patient doit retrouver son autonomie physique
Si ces critères sont respectés avec un réseau social adapté et avec un suivi clinique disponible, les patients
peuvent rentrer à domicile 2 à 4 jours après chirurgie colorectale. Dans ces conditions, la chirurgie FT
n'augmente ni les complications ni le taux de réadmission.
Nouveautés et controverses
A propos de la chirurgie laparoscopique dans FT:
Actuellement, la chirurgie colorectale est de plus en plus réalisée par laparoscopie, avec un net avantage en
terme de durée d'hospitalisation, d'analgésie et de confort du patient, et ce même sans programme FT (12, 13).
De manière intéressante, les données suggèrent qu’une chirurgie laparoscopique suivie de soins traditionnels
présente de moins bons résultats qu´une chirurgie ouverte intégrée dans un programme FT (7, 12, 13). Par
conséquent, les principes de la chirurgie FT sont de plus en plus appliqués en chirurgie colique coelioscopique
aussi. Une grande étude multicentrique randomisée a comparé le programme FT et SC dans la chirurgie
laparoscopique et ouverte (14); les résultats préliminaires (communication personnelle) soulignent l’avantage
de la combinaison entre la cœlioscopie et les autres principes fast track comme décrit en 1995 déjà (2). Tandis
que l'analgésie péridurale fait partie intégrante des résections à ciel ouvert, son bénéfice reste controversé
pour les operations par laparoscopie (11).

FCC19 Réhabilitation rapide en chirurgie digestive : les limites du fast tract
Est ce que la chirurgie FT est spécifique à la chirurgie colorectale?
Le programme FT a tout d'abord été développé pour la chirurgie colique (4, 7, 10). Les principaux éléments
sont maintenant couramment employés en chirurgie ouverte et laparoscopique abdominale (pancréatectomie
et oesophagectomie) mais aussi vasculaire (anévrisme de l'aorte) et pulmonaire (7, 15, 16).

FCC19 Réhabilitation rapide en chirurgie digestive : les limites du fast tract
Tableau 1 Key facors of fast track surgery
Item
Recommendation
Grade
Preadmission
counselling
Oral and written; details on recovery
n.a.
Pre
-
OP bowel preparation
No routine for resection above peritoneal reflection
A
Pre
-
OP fasting
2h for liquids, 6h for solids; pre
-
OP carbohydrate loading
A
Pre
-
anesthetic
medication
Short
-
acting medications preferable
A
Thromboembolic prophylaxis
Sc heparine (
unfractionated or low
-
molecular
-
weight
)
A
Antibiotic prophylaxis
Single shot covering anaerobes and aerobes 1h before surgery
A
Standard anesthetic protocol
Avoid
opioids; mid
-
thoracic EDA
A
Prevention of PONV
Medical prophylaxis if
≥
2 risk factors present
n.a.
Laparoscopy
Preferable if performed by experts
A
Surgical incision
Minimal incision length; midline or transverse acceptable
n.a.
Nasogastric tube
No
routine use; insertion if ileus develops
A
Intraoperative normothermia
Upper
-
body forced
-
air heating cover to prevent hypothermia
A
Perioperative fluids
Restrictive intra
-
and post
-
OP fluid management
A
Intraabdominal drains
No routine for resection
above peritoneal reflection
A
Urinary catheters
Suprapubic for pelvic surgery, otherwise urethral
acceptable
A
Ileus prevention
EDA, fluid restriction, minimal
-
invasive surgery
; +/
-
drugs
A
Post
-
OP analgesia
EDA and paracetamol
; NSAID after EDA removal
A
Post
-
OP nutrition
Oral diet at will after surgery +/
-
nutritional supplements
A
Early mobilisation
2h out of bed on the day of surgery, 6h thereafter
n.a.
Audit
Systematic audit to allow quality control and benchmarking
n.a.
Adapted actual guidelines on perioperative care in colorectal fast track surgery (10).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%