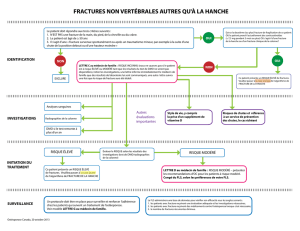
CHIRURGIE DE L`APPAREIL LOCOMOTEUR

1
1
CHIRURGIE DE L’APPAREIL LOCOMOTEUR
Volume 1
Professeur J.J. RO
M
BOUTS et
Professeur Ch. DELLOYE
AVERTISSE
M
ENT
Ce syllabus est un aide-mémoire complémentaire aux notes manuscrites.
Il est rédigé de façon à ce vous puissiez rapidement retrouver l’information souhaitée.
Cette information a été volontairement limitée à l’essentiel pour que ce manuel reste compact et
pratique. Il ne saurait en aucune manière se substituer à un traité de chirurgie osseuse.
Certains chapitres ont dans cette troisième édition été développés et vous sont soumis à titre
d’information. Ils ne doivent pas être étudiés en détail. Il est plus important de saisir l’essentiel de leur
contenu (ch. 4, 5, 6). Ils sont présentés en simple interligne.
Toute suggestion ou commentaire à propos de la présentation ou du contenu du syllabus sera la
bienvenue.
Livres conseillés
Elémentaires
HEI
M
U. BALTENSWEILER J. Traumatologie. Collection : Checklists de
M
édecine. Thieme
Flexibook.
BAU
M
GARTNER R., OCHSNER P.E. Orthopedie. Collection : Checklists de
M
édecine. Thieme
Flexibook.
JODOIN A. et al. Orthopédie et Traumatologie. Un guide clinique. Université de
M
ontréal. Decarie.
M
aloine (Quelques affirmations discutables).
DEJEAN O. Orthopédie - Traumatologie. Editions
M
ED-LINE Paris (questions d’internat.)
G.E.O.P. Orthopédie pédiatrique.
M
éditions. Lyon. (tél. : 0033.4.72.78.01.30) (un classique !).
N.B.: ce syllabus sera en libre accès par internet sur le site du G.E.O.P. dès janvier 2000.
L’équivalent en anglais, richement illustré
M
c RAE R., KINNIN
M
ONTH A.W.G. Orthopaedics and trauma. An illustrated colour text.
Churchill. Livingstone 1977, 152 pages.
Pour ceux qui se destinent à la médecine d’urgence
SKINNER D., DRISCOLL P., EARLA
M
R. ABC of
M
ajor trauma. B
M
J Publishing Group. Second
edition 1996, 146 pages.
Plus documenté
R. DEE, L.C. HURST,
M
.A. GRUBER, S.A. KOTT
M
EIER. Principles of Orthopaedic Science.
M
cGRAW-HILL ISBN0070163561 (l’achat des futurs orthopédistes...).
Le « must » des futurs pédiatres
A. DI
M
EGLIO. Orthopédie pédiatrique quotidienne. Sauramps
M
édical. (épuisé en 11.99)
Pour ceux qui souhaitent surfer sur internet

2
2
http://www.worldortho.com/
Electronic Orthopaedic Textbook.
Ed. Eugène Sherry. (une petite merveille de précision et de concision...)
Voir "orthopédie" dans la bibliothèque didactique sur le site de l'UCL: http://www.md.ucl.ac.be/luc/netlinks.htm
Correspondance : Pr. Rombouts : Service d’Orthopédie, Clin. St-Luc, Bruxelles.
Pr. Delloye : UCL, T. Pasteur, Ortho 5388.
CHAPITRE I : GENERALITES
1. Définitions
L’Orthopédie et la Traumatologie sont deux disciplines de la médecine dont le but est de prévenir et de
traiter les affections de l’appareil locomoteur sans limite d’âge, par des moyens médicaux et/ou
chirurgicaux. La conservation ou la restitution de la fonction articulaire nécessite la plupart du temps la
collaboration des infirmiers et des kinésithérapeutes.
L’appareil locomoteur comprend la colonne vertébrale et les quatre membres. Il est constitué de
segments osseux articulés et animés par les tendons et les muscles. Ces différentes structures sont
innervées et vascularisées à l’exception du cartilage.
L’appareil locomoteur a pour fonction de permettre à l’homme de se déplacer et de pouvoir réaliser de
nombreuses activités par le mouvement.
2. Structures de l’appareil locomoteur
Le squelette est un ensemble de structures osseuses fixes et résistantes, reliées entre elles par des
articulations. Les muscles et leurs tendons mobilisent efficacement, à un coût énergétique réduit, les
segments de membres sous le contrôle du système nerveux. Enfin, la vascularisation assure l’apport
nutritif pour le fonctionnement de l’ensemble.
2.1. L’os
L’ensemble des os forme le squelette qui constitue la charpente du corps et sert d’ancrage aux tissus
mous (tendon, muscle, ligament). Le squelette a un rôle de soutien et un rôle métabolique
(hématopoïèse de la moelle osseuse, phagocytose des hématies âgées, réservoir de calcium, cfr. notes de
rhumatologie).
L’os est un tissu vivant, élaboré et régulé par différentes cellules osseuses (ostéoblastes, ostéocytes,
ostéoclastes), elles-mêmes sous contrôle d’autres systèmes régulateurs (cfr. notes de rhumatologie).

3
3
Environ 5 % de la masse osseuse totale sont renouvelés annuellement chez l’adulte.
A l’échelle microscopique, l’os est constitué de minéral (65 % du poids total de l’os), de matière
organique (25 %) et d’eau (10 %).
La phase minérale est faite de phosphate et de calcium sous forme cristalline (principalement
l’hydroxyapatite). Pour un individu de 70 kg, le calcium représente 1,300 g dont 99 % sont dans les os
et les dents. Environ 1 % est échangeable avec les liquides extracellulaires. Le phosphore est présent
sous forme de phosphate. Chez une personne de 70 kg, il représente environ 700 g dont 80 % sont
dans les os sous forme d’hydroxyapatite [Bonjour et Rizzoli, Med. hyg. 47 ; 815, 1989].
La phase organique est représentée à 90 % par le collagène, le reste étant d’autres protéines
(protéoglycanes, glycopeptides) qui semblent jouer un rôle régulateur dans le métabolisme du tissu
osseux.
Ce sont les cellules osseuses qui synthétisent la matrice osseuse et qui contrôlent ensuite dans un
deuxième temps sa minéralisation. Le minéral est situé dans et autour de la fibre collagène. Cette
intrication confère à l’os des propriétés mécaniques remarquables et adaptées à sa fonction de
charpente. La fibre collagène lui donne sa résistance à la traction tandis que le minéral apporte la
résistance à la compression.
M
acroscopiquement, on distingue dans le squelette des os plats (crâne et les os de la face, omoplate,
bassin) et des os longs (squelette appendiculaire).
Un os long est composé d’une diaphyse (partie centrale de l’os) qui circonscrit la cavité médullaire et,
de part et d’autre, d’une métaphyse et d’une épiphyse, séparées par la physe ou cartilage de la
croissance.
La diaphyse est faite d’os compact dit « os cortical ».
L’épiphyse et la métaphyse sont composées d’ « os spongieux » constitué d’os disposé en travées
entre lesquelles circule la moelle osseuse.
L’os spongieux assure une répartition plus uniforme des contraintes et un transfert de celles-ci à la
diaphyse. Cet os est riche en cellules capables de produire de l’os (ostéoblastes). La crête iliaque du
bassin contient également de grandes quantités d’os spongieux (voir à greffe).
2.2. Les articulations
L’articulation est la structure de base du mouvement et celle par laquelle les os s’unissent entre eux.
Elle permet aux muscles de mobiliser le squelette.

4
4
On distingue surtout deux types d’articulation dans l’appareil locomoteur :
− l’amphiarthrose ou symphyse unit les os par un tissu composé de cartilage et de fibrocartilage
(pubis, disque intervertébral). Elle ne permet que peu de mouvement;
− la diarthrose est une articulation synoviale, caractérisée par une cavité entre les surfaces osseuses qui
sont recouvertes de cartilage hyalin. La cavité peut être divisée par une structure fibrocartilagineuse
appelée ménisque, qui assure une meilleure juxtaposition (coaptation) des surfaces articulaires. Elle
permet le mouvement le plus grand.
2.3. Le cartilage
Le cartilage articulaire est un cartilage hyalin, lisse et brillant. Il est constitué d’une matrice solide,
synthétisée par les chondrocytes (cellules du cartilage) et d’eau. La matrice, très hydrophile, contient
70 % de fibres collagènes et 30 % de protéoglycanes.
La matrice hydrophile assure la résistance aux pressions, capable de supporter une charge de 350
kg/cm2 (rôle d’amortisseur) et constitue une surface de glissement idéale.
Le cartilage est une structure particulière car il est dépourvu d’innervation et d’irrigation sanguine.
Le liquide synovial, sécrété par le tissu synovial, apporte par diffusion les nutriments nécessaires au
cartilage et par sa viscosité, le lubrifie.
2.4. Le cartilage de croissance
Le cartilage de croissance est un tissu cartilagineux spécialisé et temporaire qui assure la croissance
longitudinale de l’os. Schématiquement il est composé, de l’épiphyse vers la diaphyse :
− d’une zone de cellules de réserve dites germinales (couche de réserve),
− d’une zone de croissance (couche sériée), où les cellules commencent à proliférer et à se grouper en
colonne (c’est ici que se fait la véritable croissance par division cellulaire),
− d’une zone d’hypertrophie (couche hypertrophique) des cellules qui progressivement dégénèrent
(c’est ici que se fera la fracture du cartilage de croissance),
− d’une zone de transformation (couche dégénérative) avec l’apparition d’une calcification de la
matrice entourant les cellules qui s’hypertrophient,
− enfin, la zone d’ossification où l’invasion vasculaire du cartilage calcifié détruit celui-ci et est
remplacée par de l’os nouvellement formé.

5
5
2.5. L’appareil capsulo-ligamentaire
La membrane synoviale tapisse l’intérieur de la cavité articulaire et les ligaments intraarticulaires. Le
liquide synovial est riche en acide hyaluronique qui lui confère une haute viscosité.
La capsule articulaire est constituée d’un tissu fibreux dense. Elle soutient la synoviale. Elle est
renforcée à certains endroits par des épaississements de la capsule appelés ligaments. D’autres
ligaments possèdent la même structure qu’un tissu fibreux mais sont individualisés de la capsule. Cet
ensemble capsule et ligament confère la stabilité à l’articulation et permet de résister à des sollicitations
importantes. Le ligament peut être considéré comme un frein passif, par opposition au muscle qui peut
agir comme frein volontaire.
2.6. Le tendon
Le tendon est constitué d’un tissu conjonctif dense. Le collagène en est le constituant le plus important
et est synthétisé par les fibroblastes. Il contient en plus de l’élastine. Certains tendons sont entourés
d’une gaine synoviale. La vascularisation du tendon est assurée via une structure conjonctive lâche
(paratendon) permettant sa course.
Le tendon unit son muscle à l’os par un tissu fibreux très résistant.
Le tendon d’Achille, composé du soléaire et du gastrocnémien, est le plus puissant du corps, pouvant
supporter des charges d’environ 5 kg/mm2 (+ 400 kg chez l’adulte) [Dupuis-Leclaire, Pathologie de
l’appareil locomoteur, Maloine, 1986].
2.7. Le muscle
La puissance d’un muscle est proportionnelle au nombre de fibres musculaires (masse musculaire), de
sa morphologie et du bras de levier : plus le bras est long (c.-à-d. éloigné du centre du mouvement), plus
la force résultante est grande. Les muscles sont richement vascularisés et innervés.
2.8. Le nerf périphérique
Le nerf périphérique est constitué d’un ensemble de fascicules nerveux constitués de fibres nerveuses.
Chaque fibre est composée d’un axone, prolongement cytoplasmique du neurone et dont la longueur
peut varier d’un millimètre à plus d’un mètre. L’axone est entouré d’une fine gaine (gaine de Schwann).
Le nerf est entouré d’une gaine externe dite épinèvre. Chaque fascicule est également limité par une
périnèvre.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
1
/
129
100%