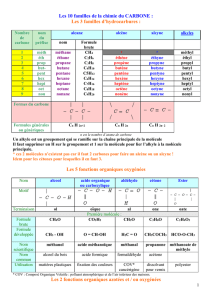
Les liaisons chimiques (E forte)

Electronégativité
Les liaisons chimiques et les interactions moléculaires
Introduction
Une molécule est un édifice polyatomique stable batti à partir d’une combinaison d’atomes qui
mettent en jeu des liaisons chimiques. La liaison ne se forme que si l’édifice est plus stable que les
atomes isolés.
Pour deux éléments C et D, il existe une distance optimale d pour laquelle l’énergie est minimale,
c’est la stabilisation, la formation de la liaison. Si les deux atomes sont trop proches, il y a répulsion.
Si la longueur de liaison d est inférieure à la somme des deux rayons atomiques, on observe une
interpénétration des nuages électroniques. La longueur de liaison d varie en fonction de la nature
des éléments chimiques liés.
La plupart du temps, l’énergie d’une liaison chimique est donnée positivement : il s’agit de l’énergie
de rupture de cette liaison. Plus la valeur de l’énergie E est grande, plus la liaison est stable (difficile à
rompre).
Plus une liaison est courte, plus elle est stable. Plus une liaison est multiple, plus il faut apporter
d’énergie pour la rompre, et donc plus elle est stable.
Il existe plusieurs types de liaisons chimiques. La nature de la liaison chimique entre deux éléments
peut être différente.
Partie 1 : Les liaisons chimiques (E forte)
I. L’électronégativité
Lorsqu’un élément chimique est engagé dans une liaison, l’électronégativité X est une grandeur qui
représente l’aptitude d’un élément à attirer vers lui les électrons de la liaison chimique.
X(B) > X(A) B est plus électronégatif que A
B a attiré les électrons de la liaison vers lui, il est électronégatif. A les a laissé partir, il est
électropositif. Les charges δ+ et δ- sont des charges fictives qui traduisent le fait qu’un des deux
éléments possède plus d’électrons que lorsqu’il était isolé et l’autre moins.

L’électronégativité augmente de gauche à droite dans une période et de bas en haut dans une
colonne. Les gaz nobles n’ont pas d’électronégativité car ils ne sont pas engagés dans des liaisons
chimiques. F est le plus électronégatif : F > O > N > … > alcalins
Seuls F,O et N vont former des « liaisons « hydrogènes car ils sont les plus petits et possèdent une
fort concentration de charges.
Cl est légèrement plus électronégatif que N mais ne formera pas de liaison H car il est trop
volumineux.
L’électronégativité possède une grande importance dans le polarisation des liaisons chimiques et la
réactivité des molécules.
Notion de métal/ non métal :
Les métaux sont des éléments électropositifs et possèdent un caractère réducteur (= capacité à céder
un ou pls électrons). Les non-métaux sont des éléments électronégatifs et possèdent un caractère
oxydant (= capacité à gagner un ou plusieurs électrons).
Le caractère métallique d’un élément augmente de droite à gauche dans une période.
II. Liaison ionique
La liaison ionique se rencontre entre des éléments chimiques ayant une différence
d’électronégativité importante. Un atome possède une valeur de X élevée et l’autre très faible.
Il y a ionisation plus ou moins totale de liaison. Dans la liaison ionique, un atome prend une charge
positive réelle et l’autre une charge négative réelle. La liaison ionique s’établit préférentiellement
entre des éléments du bloc s et du bloc p.
Les électrons appartenant initialement à Na (X faible) est presque totalement transféré à Cl (X
élevée) Formation de NaCl
Il se forme ainsi des interactions électrostatiques très fortes entre les cations et les anions de charges
opposées se qui permet la formation d’un édifice très stable.
III. Liaison covalente
A. Modèle de Lewis
La liaison covalente se rencontre entre des éléments chimiques ayant un différence
d’électronégativité faible (ou nulle). Si DX = 0 liaison apolaire. Si DX =/= 0 liaison polaire

Représentation d’un atome
Chaque atome est entouré d’un nombre d’électrons correspondant au nombre d’électrons
périphérique seulement = électrons de valence.
Règle de l’octet
Les atomes s’unissent en mettant en commun un ou plusieurs électrons périphériques. Un gaz noble
possède 8 électrons de valence stabilité
Règle de l’octet = Chaque atome engagé dans une liaison tend à atteindre un état de stabilité, c'est-
à-dire 8 électrons périphériques (sauf pour H qui tend vers 2 électrons périphériques).
Molécules homonucléaires (avec liaison simple)
Homonucléaire = atome de même nature
La règle de l’octet est respectée dans Cl2 : le doublet de liaison est commun, il est compté pour
chaque atome séparément.
Molécules hétéronucléaires

Hétéronucléaire = atome de nature différente
Les doublets non liant sont essentiels dans les propriétés physico-chimiques des molécules. Mais le
modèle de Lewis a des limites, il ne rend pas compte de la géométrie spatiale des molécules.
Molécules hétéronucléaires ne respectant pas la règle de l’octet
Limite de la règle de l’octet : le nombre d’électrons qui entoure un atome dans une molécule peut
être inférieur ou supérieur à 8 électrons. La règle de l’octet est la plupart du temps respectée pour
les éléments de la 2e période. Mais à partir de la 3e période, elle l’est moins.
Base et Acide de Lewis
Un acide de Lewis est une molécule qui possède une lacune en électron, c'est-à-dire un déficit en
électrons. C’ est donc un accepteur d’électron. Ex H+
Une base de Lewis est une molécule qui possède des doublets non liants d’électrons. C’est donc un
donneur d’électrons. Ex : H2O…
Molécules à liaison multiples
Lorsque 2 paires d’électrons sont mises en commun on parle de liaison double. O2 = 2 doublets non
liants par atome + 2 doublets de liaison.

Lorsque 3 paires d’électrons sont mises en commun on parle de liaison triple. N2 = 1 doublet non
liant par atome + 3 doublets de liaison.
Limite de la méthode de Lewis = toutes les liaisons sont-elles équivalentes ?
Liaison de coordination de molécules complexes (dative)
La liaison de coordination est à l’origine de la formation des molécules complexes :
A + nB Complexe
A est capable de crées plusieurs liaisons de coordination avec plusieurs bases de Lewis.
A = Acide de Lewis
B = Base de Lewis = liguand
Propriété d’une liaison covalente
o Liaison forte
L’énergie de rupture de la liaison dépend :
- Longueur de liaison
- Nature des éléments chimiques
- Multiplicité de la liaison : simple, double, triple
Quand la multiplicité augmente, la longueur de liaison diminue, l’énergie nécessaire à la rupture
augmente.
o Polarisation des liaisons
Pour les molécules hétéronucléaires, si un élément est plus électronégatif que l’autre, il attire les
électrons du doublet vers lui, des charges apparaissent.
La polarisation d’une liaison donne un caractère ionique partiel à cette liaison. Cette polarisation est
à la base de la réactivité de la molécule. La géométrie de la molécule est également importante pour
la polarisation (le modèle de Lewis n’explique pas la géométrie moléculaire, ni la différence entre les
liaisons).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%