DS4 - Classe mutuelle

1
Nom & Prénom : Classe de Terminale S
Devoir n°4 de Chimie
Analyse structurelle et spectrale – Mécanismes réactionnels
Etude de trois médicaments
L’annexe est à rendre avec la copie
Document 1. Le paracétamol
Le paracétamol, contraction de para-acétyl-amino-phénol, a été synthétisé pour la première fois
par Harmon Northrop Morse en 1878. Le paracétamol découvert par Morse ne fut commercialisé qu’une
cinquantaine d’années plus tard sous le nom de paracétamol. Il fait partie de la classe des antalgiques
antipyrétiques non salicylés.
Il est indiqué dans le traitement symptomatique de la fièvre et des douleurs d'intensité faible à
modérée, seul ou en association à d'autres analgésiques. Contrairement à l'aspirine, il est dépourvu de
propriétés anti-inflammatoires et n'agit pas sur l'agrégation plaquettaire.
Document 2. L’aspirine
Le nom scientifique de l’aspirine « acide acétylsalicylique » vient du latin salix
« saule », cet acide ayant été isolé pour la première fois dans l'écorce de cet arbre.
C’est la société de chimie Bayer qui dépose en 1899 le nom de marque Aspirin.
Ce médicament, l’un des plus consommés au monde, possède des propriétés
antalgiques, antipyrétiques et anti-inflammatoires. Il est aussi utilisé comme antiagré-
gant plaquettaire. C’est pourquoi l’aspirine peut être utilisée de manière préventive
pour diminuer le risque de formation de caillots sanguins responsables des accidents
vasculaires cérébraux (AVC).
Document 3. L’ibuprofène
L'ibuprofène a été développé par les chercheurs de chez Boots, dans les années 1960, à la suite
d'un test systématique des propriétés antipyrétiques et analgésiques de 600 molécules potentielles.
« Ibuprofène » est la dénomination commune internationale de l'acide alpha-méthyl-[4-(2-
méthylpropyl)- phényl]propanoïque qui constitue la substance active de divers médicaments comportant
des propriétés anti-inflammatoires, antalgiques et antipyrétiques utilisée pour soulager les symptômes de
l'arthrite.

2
Document 6. Table de données pour la spectroscopie IR
famille
liaison
nombres d’onde (cm-1)
cétone
C = O
1705 - 1725
aldéhyde
Ctri – H
C = O
2700 -2900
1720 - 1740
acide
carboxylique
O – H
C = O
2500 - 3200
1740 - 1800
ester
C = O
1730 - 1750
alcool
O – Hlié
O – Hlibre
3200 – 3450
3600 - 3700
Document 4. Formule topologique des trois molécules
Aspirine Paracétamol Ibuprofène
C9H8O4 C8H9NO2 …………………
Document 5. Électronégativité (échelle de Pauling) de quelques éléments chimiques
Numéro atomique
Nom
Symbole
Électronégativité (Pauling)
1
Hydrogène
H
2,20
6
Carbone
C
2,55
7
Azote
N
3,04
8
Oxygène
O
3,44

3
Document 7. Table 1 des déplacements chimiques en ppm en RMN du proton
Document 8. Table 2 des déplacements chimiques en ppm en RMN du proton
1ère partie : Etude structurelle
1. Citer deux propriétés communes aux trois médicaments. Quelle propriété particulière possède l’aspirine ?
2. 2.a. Quelles fonctions autres que la fonction alcène possède l’aspirine ?, le paracétamol ?
2.b. Quelle est la formule brute de l’ibuprofène ?
3. 3.a. L’une des trois molécules est chirale. Définir le terme « chirale » puis identifier de quelle molécule
il s’agit en justifiant pourquoi. On notera le signe de la chiralité sur l’atome de la molécule qui convient
en annexe p. 8 .
3.b. Comment nomme-t-on le type d’isomérie concerné par cette propriété ?
3.c. Dessiner les deux isomères en question dans la représentation de CRAM en annexe p. 8 . Pour
simplifier, on pourra remplacer le plus gros groupe, comportant le cycle par la lettre Z.
3.d. Que peut-on dire des propriétés physicochimiques et biochimiques de ces isomères ?

4
2ème partie : Etude d’un mécanisme réactionnel
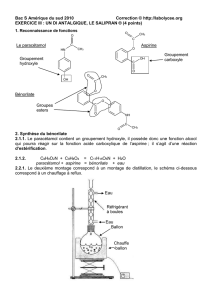
La synthèse du paracétamol peut être réalisée au laboratoire à partir du para-aminophénol et de
l’anhydride éthanoïque. L’équation de la réaction de la synthèse est la suivante :
Cette réaction peut se décomposer en plusieurs étapes :
1. Identifier, en justifiant votre réponse, les deux sites donneurs de doublets d’électrons
présents sur la molécule de para-aminophénol.
2. 2.a. Reproduire sur votre copie, l’étape n°1 de ce mécanisme et représenter la (ou les)
flèche(s) courbe(s) qui rend(ent) compte de l’obtention de l’intermédiaire A.
2.b. Indiquer la catégorie de chacune des réactions des trois étapes du mécanisme.
3. Un autre déplacement de doublets d’électrons pourrait intervenir dans l’étape 1 et produire
un autre intermédiaire B différent de l’intermédiaire A.
3.a. Représenter ce déplacement de doublets d’électrons, en reproduisant sur votre copie
cette première étape qui conduirait à l’intermédiaire B.
La question suivante est une question BONUS, à ne faire que quand le reste sera terminé !
3.b. À partir de cet intermédiaire B, et en supposant deux étapes analogues aux étapes 2 et
3, donner la formule topologique du produit final E qui serait alors formé.

5
3ème partie : Identification de médicaments
Dans un hôpital, trois piluliers destinés à des malades différents ont été mélangés. Ils
contiennent tous les trois des comprimés antalgiques blancs impossibles à distinguer. Les comprimés
sont envoyés au laboratoire de l’hôpital pour procéder à une analyse spectrale rapide et pouvoir les
identifier.
Voici les spectres obtenus pour chacun…
COMPRIME n°1
Spectre IR n°1
Spectre RMN n°1
4 protons H du cycle
1 signal multiplet
 6
6
 7
7
 8
8
1
/
8
100%