Aujourd`hui, on admet que lors d`injection périnerveuse, une

53econgrèsnationald’anesthésiee
Infirmiers.Infirmier(e)sanesthési
©2011Sfar.Tousdroitsréservés.
tderéanimation.
stesdiplômé(e)sd’état
Nouveautéssurlatoxicitéd
.‐M.Malinovsky,M.‐P.Terrien
esanesthésiqueslocaux
J
S
E
erviced’AnesthésieRéanimation,Pôl
‐mail:
eURAD,HôpitalMaisonBlanche,51092Reimscedex
jmmalinovsky@chu‐reims.fr
POINTSESSENTIELS
• L’incidencedescomplicationstoxiquessystémiquesdesanesthésiqueslocauxest
rare. Ce type de complication est décrit avec tous les anesthésiques locaux
utilisés pour l’anesthésie locorégionale. Le respect des bonnespratiquesde
inject nées e t repérage,d’ ionfraction etduresp ctdesdosestotalesinjec ées enest
lameilleureprévention.
• La toxicité systémique des anesthésiques locaux se manifeste par de signes
neurologiques(signessubjectifs,puissignesobjectifs)etdestroublesdurythme
cardiaque.Lessignesneurologiquesetlestroublesdurythmeventriculairessont
dessignesdegravitédeleurtoxicitésystémique.
• En cas de convulsions sans atteinte cardiaque, on injecter un anticonvulsivant
(midazolamoupropofol)ouuneémulsionlipidique.
• dEn cas e troubles de conscience, il faut protéger les voies respiratoires d’une
inhalationenréalisantuneintubationtrachéale.
• En cas d’arrêt cardiaque, la réanimation doit impérativement débuter par un
massagecardiaqueexterne.L’utilisationd’adrénalinepeutrenforcer le bloc
induitparlesanesthésiqueslocaux.
• Encasdetroublesdurythmeavecunepressionartérielletoujours présente
o f o apermettant uneperfusionc ronaireeficace, npeut dministrer de première
intentionuneémulsionlipidique.
• L’efficacité des émulsions lipidiques pour traiter les troublesdurythme
acardiaqueinduitsparlesanesthésiqueslocauxaétémontréeaul boratoire,et
rapportéechezquelquespatients.
• oIlexisteunefixationplusrapidedesanesthésiquesl cauxsur les solutions
lipidiquesàchaîneslonguesquesurlessolutionslipidiquesàchaînesmoyennes.
• Il est recommandé de disposer d’émulsions lipidiques près des salles où sont
réaliséeslesanesthésieslocorégionales.Ladoseoptimaled’émulsionlipidiqueà
administrerdanscecasn’estpasconnue.

INTRODUCTION
Lesanesthésiqueslocauxsont desanesthésiquespouvantentraînerdescomplications
locales ou systémiques importantes (1). En dehors des exceptionnelles réactions
d’hypersensibilité allergiques, des crises porphyriques et de l’oxydation de
l’hémoglobine(méthémoglobinémie)lessignesdetoxicitésystémiquessontmaintenant
surtoutrapportésaprèsuneadministrationpérinerveusedufaitdudéveloppementde
ce type de techniques d’anesthésie locorégionale. Depuis la commercialisation des
isomères lévogyres des anesthésiques locaux, la cohorte de signes prémonitoires de
typeneurologiquesestmoinsprésentequ’aveclabupivacaïne.Dans leurs formes les
plusgraves,latoxicitésystémiquepeutconduireàl’arrêtcardiaqueetresteuneurgence
hérapeutique.Lerespectderèglesd’orpourréaliserlesinjectionsenestlameilleure
révention.
t
p
LESSIGNESDETOXICITÉSYSTÉMIQUE
Ilssontdusàlafractionlibre(nonliéeauxprotéinesplasmatiques:albumineetacide
α1glycoprotéique)desanesthésiqueslocauxaprèsleurrésorptionàpartirdel’injection
périnerveuseouàunpassagevasculaire.Quandlesconcentrations plasmatiques
d’acides sont faibles la fraction libre de l’anesthésique local augmente et majore le
risque de toxicité systémique (enfant < 6 mois, insuffisance rénale, …) (2,3). Les
premiers signes sont souvent neurologiques, parfois associés aux troubles du rythme
cardiaque en cas de résorption massive ou d’injection intraveineuse accidentelle. Le
passagevasculaireestdépendantdusited’administration.Ainsi,untroubledurythme
cardiaqueetunarrêtcardiaqueontétédécritsaprèsgargarismeàlalidocaïne(4).La
résorptionaprèsinjectionintercostaledesanesthésiqueslocauxestrapide.Danscecas,
l’intérêtd’injecterunesolutionadrénalinepermetderalentirlavitessedepassagedans
cetypedeblocetclassiquementd’allongerladuréedubloc.Encasdebronchoscopieou
echirurgieplastiquelarésorptionpeutêtretrèsretardée(jusqu’àplusde24heures
prèsanesthésieditetumescente)(5,6).
d
a
SIGNESDETOXICITÉNEUROLOGIQUESYSTÉMIQUE
LeseffetsdesanesthésiqueslocauxsurleSNCsontbiphasiques.Dansunpremiertemps
ilyastimulation(signessubjectifsprémonitoires)puisdépression du SNC (toxicité
objective).Lessignessubjectifssontsurtoutdécritsparlepatient(intérêtderéaliserles
injectionschezun sujet éveillé pourpouvoirles décrire). Il s’agit d’engourdissements
(lespicotementspéribuccauxsonttrèsévocateurs),desétourdissements,dessensations
devertiges,desbourdonnementsd’oreilles,destroublesvisuelsvoireunediplopie,une
anxiété ou une somnolence. Puis des frissons, des trémulations musculaires et des
secousses musculaires apparaissent. Ces signes sont en général prémonitoires des
signesobjectifs.Ilssontunealertedevantinciteràl’arrêtdesinjectionsd’anesthésique
local.

Lessignesobjectifssontlapertedeconscience,lesconvulsionspuislecomaetla
dépressionrespiratoire.L’incidencedestroublesdeconscienceetladépression
respira 1é etoires sont peut fréquents, estimés à /500 blocs d’après une tud déjà
anciennedeBrownetal.(7).
Selon les propriétés physicochimiques des anesthésiques locaux les signes
rémonitoires peuvent ne pas être rapportés (ropivacaïne et lévobupivacaïne) et les
roublesneurologiquesseraientplusfréquentsaveclamépivacaïneetlalidocaïne.
p
t
LESSIGNESCARDIOVASCULAIRES
Lestroublesdeconductioncardiaquesontdessignesdegravitédelatoxicitécardiaque
au même titre que les signes neurologiques objectifs. Les premiers signes sont
l’élargissement du complexe QRS sur l’électrocardiogramme. Cet élargissement est
majoréencasd’augmentationdelafréquencecardiaque(adrénaline, bloc dit «use‐
dependant»)Puislapertedelaconductionauriculoventriculaireinduiteparles
anesthésiques locaux va permettre l’apparition de troubles du rythme ventriculaires,
principalement par phénomène de réentrée au niveau du tissu de conduction
ventriculaire. Ceci aboutit à la tachycardie ventriculaire observée, la fibrillation
ventriculaire,voirel’arrêtcardiaque.Leblocagedelaconductionauriculoventriculaire
est secondaire au blocage des canaux ioniques transmembranaires (sodiques,
potassiques et calciques selon les doses injectées). Une fois entrés dans la cellule, les
anesthésiqueslocauxvontbloquerlachaînerespiratoiremitochondrialecellulaire(8,9).
Les isomères lévogyres (lévoropivacaïne et lévobupivacaïne) entrainent une toxicité
cardiaque moindre que celle induite par la bupivacaïne (10‐12).C’estlaraisonde
l’utilisationdeplusenplusrépanduedelévoropivacaïneetlévobupivacaïne.
L’effet inotrope des anesthésiques locaux survient quand leurs concentrations
lasmatiquessonttrèsélevées,aumoins10foissupérieuresàcelles provoquant les
roublesdurythmecardiaque.
p
t
LESFACTEURSFAVORISANTLATOXICITÉSYSTÉMIQUEDESANESTHÉSIQUES
LOCAUX
Ilssontmultiples et souventassociés.Ladose injectéeetrésorbéedanslacirculation
sanguine est le principal facteur de toxicité. Selon le type d’anesthésique local,
l’adjonction éventuelle d’un vasoconstricteur, et le site d’injection les concentrations
plasmatiques après injection d’anesthésique local sont différentes. La résorption des
anesthésiques locaux est rapide après injection dans le scalp, les blocs de la face, les
blocsdelarégioncervicaleetpourlesblocsdutronc.Elleestrapideaprèslesblocsdu
membresupérieuretpluslentepourlesblocsdumembreinférieuretdupérinée.La
résorpt p a é
qu’aprè t
ionsanguineest luslenteaprès uner chianesth sie(etladoseinjectéefaible)
sanes hésiepéridurale.
Éviter l’injection d’anesthésique dans une zone inflammatoire ou d’infection,

réaliserl’injectionenfractionnantlesdosesetenrespectantlesdosestotalesàinjecter
sont des recommandations de bonne pratique. Les doses maximalesàrespecterpour
chaqueanesthésiquelocalsontrésuméesdansletableau1.Ellesontétéétabliesàpartir
desdonnées de lalittérature chez des sujets sains. Il fautprobablementdiminuer les
doses maximales à injecter dans certaines situations physiologiquesetencasde
comorbidité.Chezlespetitsenfants(<6mois),lesfemmesenceintesouchezlespatients
avecunealtérationdelafonctionrénalelesconcentrationsenacideα1glycoprotéique
sont diminuées, donc la fraction libre de l’anesthésique local augmentée. Des signes
systémiques (convulsions, arrêt cardiaque) sont parfois rapportés chez les patients
insuffisantsrénauxaustadeterminalenrespectantladosetotaledel’anesthésiquelocal.
Al’inverse,lesétatsinflammatoires,lachirurgieetlapériodepostopératoiressontdes
circonstancesdanslesquelleslesconcentrationsplasmatiquesd’acideα1glycoprotéique
ont augmentées, expliquant la faible incidence de la toxicité systémique des
nesthésiqueslocauxenpostopératoire.
s
a
Tableau 1.‐ Doses à ne pas dépasser, selon la nature de l’anesthésique local injecté, avec ou sans
djonctiond’unvasoconstrticteur,selonlesRPCdelaSfarpourlaréalisationdes«blocspériphériques
esmembreschezl’adulte»publiéesen2002(13).
a
d
Solution énaline
Blocdum upérieur
non‐adr
embres
Soluti aline
Blocdum nférieur
onadrén
embrei
Lidocaïne 500mg
7mg.kg1
**30mg.kg1
700mg
10mg.kg1
Mépivacaïne 400mg
51
6mg.kg
400mg
51
6mg.kg
Ropivacaïne 225mg
3mg.kg1
300mg
4mg.kg1
Bupivacaïne 150mg
2mg.kg1
180mg
2,5mg.kg1
Lévo‐bupivacaïne 200mg
3mg.kg1
**anesthésietumescente(injectionsous‐pressionpourlacuredelipoaspiration)
LAPRISEENCHARGETHÉRAPEUTIQUE
Lapriseenchargedessignesneurologiquesetcardiovasculairesenrapportavecune
toxicité des anesthésiques locaux est une urgence thérapeutique. Les troubles
neurologiquessontsouventannonciateursdestroublesdurythmecardiaque.Laprise
en charge a significativement changé depuis quelques années après la publication de
réanimation accélérée des patients présentant une toxicité systémique des
anesthésiqueslocauxgrâceauxémulsionslipidiques.
Lestroublesdurythmesontdusaublocagedesrécepteursioniquestransmembranaires
delaparoiducardiomyocyte.Ceblocageestplusimportantsilafréquencecardiaqueest

élevée, ou accélérée par l’utilisation d’adrénaline (bloc «use‐dependant»). Avant
l’utilisation des émulsions lipidiques il était recommandé de ralentir la fréquence
cardiaqueenadministrantsoitdelaclonidinesoitdel’amiodarone.
Leprincipedel’actiondesémulsionslipidiquesn’estpastotalementconnu.L’effetdes
lipidesauniveaucellulaireestdeleverleblocdesanesthésiqueslocauxetd’apporter
des substrats énergétiques pour reprendre un métabolisme cellulaire normal.
L’efficacité des émulsions lipidiques est en partie expliquée par la grande affinité des
anesthésiqueslocauxpourcesémulsionsdufaitdeleurliposolubilité.L’affinitédépend
despropriétésphysicochimiquesdesanesthésiqueslocaux.Elleesttrèsimportantepour
la bupivacaïne, plus faible pour la lévobupivacaïne et la ropivacaïne, peu importante
pourlamépivacaïneetlalidocaïne.Cependant,l’efficacitéd’uneémulsionlipidiquepour
leverlatoxicitédelalidocaïneadéjàétérapportée.Pourleverplusrapidementlebloc
induitparlesanesthésiqueslocaux,lesémulsionsdoiventarriver dans le
cardiomyocytes et par action de masse capter les anesthésiques locauxfixéssurles
récepteursmembranaires.Ilestdoncimpératifquelacirculationcoronairesoitefficace.
Selonlanaturedel’émulsionlipidique,l’affinitéestdifférente.Elleestplusimportante
avec les solutions lipidiques à chaînes longues (Intralipides®à20%)qu’avecles
solutionslipidiquesàchaînesmoyennes(Médialipides®à20%)(rapport2,5‐3,0:1,0).
L’affinitédesanesthésiqueslocauxpourcessolutionsestaugmentéeencasd’alcaloseet
denormothermie.Ilestpossibledevoirréapparaîtredesanomaliesdel’ECGaprèsun
traitementefficaceparleslipidesd’untroubledurythmecardiaqueparlerelargageà
partir des tissus adipeux répartis dans l’organisme. Une surveillance
électrocardioscopiquedeplusieursheures(minimum8h)s’imposedoncaprèslamise
enœuvredutraitementd’untroubledurythmeinduitparlesanesthésiqueslocaux.La
doseinitialerecommandéeparlaSfar,d’aprèslespublicationsdecascliniquesdeson
efficacité,estde3mL.kg‐1pourlasolutiond’Intralipide®à20%(soit200mLpourun
sujet de 70 kg). Certains recommandent de perfuser le reste du flacon (300 mL en
énéral)pendant2à3heures.g
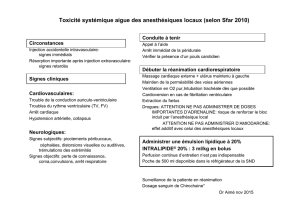
Quandlessignesneurologiquessontisolés,lesprincipesdutraitementsont:
- al (intérêt de l’injectionchezunsujetarrêt des injections d’anesthésique loc
- éveillé)
calmerlesujets’ilesttoujoursconscient
- etites doses de midazolam ou de propofol si
d
administrer un anticonvulsivant, p
u
- l’étathémodynamiqued sujetestconservé (absence ’hypotension)
administrerunesolutionlipidique
- en cas de troubles de conscience il faut protéger les voies aériennes d’une
inhalationparl(intubationtrachéale.Ilestpossiblederéaliseruneanesthésieen
séquence rapide en évitant l’hypotension artérielle et administrant un curare
d’actionrapide(succinylcholine)endehorsdesescontre‐indications
Lapriseenchargedestroublesdurythmegravedépenddel’efficacitécirculatoire.Sila
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%