Sclérose Tubéreuse de Bourneville: Étude Clinique et Génétique

1
PLAN

2
INTRODUCTION ……………………………………………………………. 5
PATIENTS ET METHODES ……………………………………………….. 10
1 Patients ……………………………………………………………………. 11
2 Critères d'inclusions ……………………………………………………. 11
3 Fiche d'exploitation …………………………………………………….. 11
RESULTATS …………………………………………………………………. 14
1 Données épidémiologiques …………………………………………… 15
1.1 Age ………………………………………………………………... 15
1.2 Sexe ……………………………………………………………… 16
2 Antécédents ……………………………………………………………… 16
3 Etude clinique ……………………………………………………………. 18
3.1 Manifestations neurologiques ……………………………… 18
3.2 Manifestations dermatologiques …………………………… 23
3.3 Manifestations cardiaques …………………………………… 27
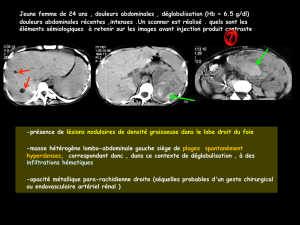
3.4 Manifestations rénales ……………………………………………… 27
3.5 Autres manifestations cliniques …………………………… 27
4 Exploration paraclinique ……………………………………………… 28
4.1 TDM cérébrale …………………………………………………. 28
4.2 Electroenchephalogramme(EEG) …………………………… 28
4.3 Echographie cardiaque ……………………………………… 28
4.5 Echographie rénale …………………………………………… 31
4.6 Exploration ophtalmologique ……………………………… 31
5 Traitement ……………………………………………………………….. 31
6 Evolution ………………………………………………………………….. 32
7 observations cliniques …………………………………………………. 33

3
DISCUSION ………………………………………………………………… 41
1 Epidémiologie …………………………………………………………… 42
2 Aspects génétiques et physiopathologie …………………………… 44
2.1 Fonction TSC 1 et TSC 2 ……………………………………… 44
2.2 Physiopathologie ……………………………………………… 47
3 Anatomopathologie …………………………………………………… 50
3.1 Les Lésions du système nerveux central ………………….. 50
3.2 Les lésions rénales …………………………………………… 53
3.3 Les lésions dermatologiques ……………………………….. 55
3.4 Les rhabdomyomes …………………………………………… 56
3.5 Lésions pulmonaires ………………………………………… 56
4 Etude clinique …………………………………………………………… 59
4.1 Manifestations neurologiques ……………………………… 59
4.1.1 Epilepsie ………………………………………………… 60
4.1.2 Retard mental …………………………………………. 63
4.1.3 Autisme ………………………………………………… 64
4.1.4 Imagerie cérébrale …………………………………… 66
4.2 Manifestations dermatologiques ………………………….. 69
4.2.1 Taches achromiques ………………………………….. 69
4.2.2 Angiofibromes du visage …………………………… 70
4.2.3 Peau de chagrin ………………………………………... 72
4.2.4 Angiofibromes unguéaux …………………………… 72
4.2.5 Autres lésions cutanéo-muqueuses ……………… 73
4.3 Manifestations rénales ………………………………………… 75
4.3.1 Signes cliniques ……………………………………….. 75
4.3.2 Signes paracliniques ………………………………….. 78
4.4 Manifestations cardiaques ……………………………………. 80
4.5 Manifestations ophtalmologiques …………………………… 83
4.6 Manifestations pulmonaires …………………………………… 85

4
4.7 Autres manifestations cliniques …………………………….. 87
4.7.1 Atteinte digestive ……………………………….…… 87
4.7.2 Atteinte osseuse ………………………………….…… 88
4.7.3 Atteinte endocrinienne ……………………………… 89
5 Diagnostic …………………………………………………………………. 90
5.1 Diagnostic positif …………………………………………….. 90
5.2 Diagnostic différentiel ………………………………………. 93
6 Aspect évolutif …………………………………………………………… 97
7 Diagnostic prénatal et conseil génétique …………………………… 100
7.1 Aspects techniques du diagnostic prénatal ……………… 100
7.2 Conseil génétique ……………………………………………… 102
8 Traitement ………………………………………………………………… 103
8.1 Traitement des manifestations neurologiques …………... 104
8.2 Traitement des manifestations dermatologiques ……… 106
8.3 Traitement des manifestations rénales …………………… 107
8.4 Traitement des manifestations cardiaques ……………… 108
8.5 Traitement des manifestations pulmonaires ……………. 108
8.6 Perspectives thérapeutiques ………………………………... 108
CONCLUSION ……………………………………………………………… 110
RESUME ……………………………………………………………………… 112
BIBLIOGRAPHIE …………………………………………………………… 116

5
INTRODUCTION
La sclérose tubéreuse de Bourneville (STB) est une maladie qui appartient au
groupe des phacomatoses. Il s’agit d'une dysembryoplasie neuro-éctodermique
correspondant à un dysfonctionnement embryologique du tissu ectodermique dont
dérivent la peau, le système nerveux et l'œil caractérisée par la survenue de
tumeurs bénignes : les hamartomes. Cette dysembryoplasie explique les atteintes
rencontrées dans cette maladie et intéressant à des degrés divers ces trois organes
principalement, et accessoirement d'autres organes comme le rein, le cœur les
glandes endocrines et d'autres viscères.
C'est une maladie familiale héréditaire, transmise selon le mode autosomique
dominant, avec cependant un taux élevé de mutations spontanées, et une
pénétrance variable expliquant les différentes formes cliniques rencontrées dans la
même famille. Deux gènes sont impliqués TSC1et TSC2 codant pour deux protéines
différentes l'hamartine et la tubérine.
Les manifestations observées au cours de cette affection sont très variables
avec des formes très discrètes (pauci symptomatiques) et des formes complètes
associant à divers degrés des manifestations essentiellement cutanées,
neurologiques, cardiaques, rénales, ophtalmologiques viscérales et osseuses. Ces
manifestations sont dominées à l'âge pédiatrique par des signes cutanés (taches
achromiques) et surtout par des signes neurologiques (épilepsie, retard mental) qui
représentent les principaux motifs de consultation.
Cette maladie pose, en plus d’un problème de délai diagnostique, un
problème de prise en charge médicale et psychologique des malades, et un
problème du diagnostic anténatal et du conseil génétique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
1
/
129
100%