Proposition de Laurent Larroche

1
Montage N°2
Expériences illustrant les propriétés chimiques des aldéhydes et des cétones.
Introduction
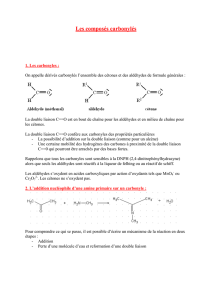
Les aldéhydes et les cétones ont en commun le groupe fonctionnel carbonyle, c’est à dire une double liaison
carbone oxygène. Dans les aldéhydes le carbone carbonylique est lié à au moins un atome d’hydrogène alors que dans
les cétones, il est lié à deux atomes de carbone. Ainsi ces produits ont des propriétés communes mais aussi des
propriétés qui les différencient. C’est ce que nous allons essayer de voir à travers diverses expériences.
I Propriétés communes
1) Addition sur la double liaison C=O
Combinaison bisulfitique
matériel:
2 tube à essai avec bouchon de caoutchouc
2 pipette pasteur.
produits:
Benzaldéhyde
acétone
métabisulfite de sodium Na2S2O5 en solution saturée (20 g dans 25 mL d’eau)
Il faut une solution fraîchement préparé de métabisulfite de sodium.
on place 5 mL de cette solution dans chaque tube à essai puis 1 mL de benzaldéhyde dans le premier et 1 mL d’acétone
dans le second.
Après avoir bouché les tubes, les agiter vigoureusement.
Avec le benzaldéhyde, on obtient un solide blanc.
Avec l’Acétone, on obtient des cristaux blancs, lent à venir. Il est possible que le précipité est du mal à apparaître, dans
ce cas mettre carrément de la poudre de Na2S2O5 dans l’acétone et rajouté quelques gouttes d’eau.
C’est une addition nucléophile sur les carbonyles.
Cette réaction est sensible à l’encombrement stérique, elle sera donc plus lente avec l’acétone.
Cette réaction peut servir à la séparation ou purification des composés carbonylés.
L’ajout d’acide, ou de base régénère les composés carbonylés en détruisant la combinaison bisulfitique.
2) Condensation sur la fonction carbonyle
a) test à la 2,4 DNPH
matériel:
Deux erlenmeyer de 50 mL ; Büchner ; Trompe à eau ; papier filtre
produits:
Benzaldéhyde, Acétone
Dans chaque erlenmeyer mettre 15 mL de DNPH, ajouter 1 mL de dérivé carbonylés.
Il y a apparition d’un précipité jaune orangé. (la couleur varie selon le composé carbonylé de départ)
Filtrer le solide sur Büchner, rincer avec solvant froid (de l’eau si la DNPH est aqueuse), sécher sur papier filtre.
Prendre les points de fusion et vérifier qu’ils sont différents.
Hydrazone de l’acétaldéhyde (éthanal): 168 °C
Hydrazone du Benzaldéhyde: 237 °C
Hydrazone de l’acétone: 128 °C
Ainsi, même si les aldéhydes et cétones ont une propriétés communes de condensation avec la DNPH. Cette propriétés
permet de les différencier grâce aux point de fusion des 2,4-dinitrophénylhydrazone qui sont caractéristiques de
l’aldéhyde ou de la cétone de départ.
remarque:
On parle de condensation car il y a élimination d’eau au cours de la réaction
composé carbonylés + DNPH hydrazone + eau
La question classique concerne la formule de la DNPH et le mécanisme de la condensation

2
II Propriétés différenciants les aldéhydes des cétones.
1) Addition sur la double liaison
a) Réactif de Schiff
Matériel:
2 tubes à essais
Deux pipettes pasteur
Produits:
Benzaldéhyde ; Acétone ; Réactif de Schiff
Le réactif de Schiff est incolore.
Avec un aldéhyde la solution devient rose, Avec une cétone, on n’observe rien.
En utilisant le réactif de Schiff, on transforme la fonction carbonyle en alcool secondaire.
Note sur le réactif de Schiff:
(voir p52 et 53 du Bréal, expérience de chimie: TOME 1)
Le réactif de Schiff se prépare en faisant réagir du SO2 sur une solution de fuchsine. Il est incolore. Il vire au rose par
perte de SO2
* L’ajout d’aldéhyde le fait virer au rose violacé
* S’il est chauffé, il peut virer (teinte néanmoins plus rouge)
* Il vire en milieu basique
* Il peut virer par oxydation
* Il peut également virer par ajout de certain alcool
Il convient donc d’utiliser le réactif de Schiff en milieu neutre (voir légèrement acide) et à froid. A cause de ces
nombreux inconvénients, on préférera utiliser la liqueur de Felling ou le réactif de Tollens.
2) Réaction d’oxydation
Malgré de nombreuses propriétés communes dues au groupe carbonyle, aldéhydes et cétones se différencient
aisément à l’aide de réactions d’oxydoréduction. En effet l’oxydation des aldéhydes est facile, car elle peut être
ménagée, c’est à dire faite sans modifier la chaîne carbonée; en revanche, celle des cétones est difficile, car elle
nécessite une rupture de la chaîne carbonée.
a) réactif de Tollens
Note: on trouvera cette manipulation dans les livres de chimie de 1ère S.
Le réactif de Tollens est uns solution de l’ion complexe diamine argent Ag(NH3)+2
Chauffé doucement en présence d’un aldéhyde, cet ion est réduit en argent métallique qui se dépose sur les parois du
tube à essais, formant ainsi un miroir d’argent. L’ion argent est réduit en argent métal, l’aldéhyde est oxydé en ion
carboxylate.
Ag NH
R CHO O
( )
3 2
+ e Ag + 2NH
+ 3OH R-COO + 2H + 2e
-3
- - 2-
_________________________________________________
2A + + 3OH R-COO + 2H + 2Ag + 4NH
- - 2 3
gNH R CHO O( )
3 2
remarque:
1)Cette réaction a un rendement faible, on ne s’en sert que comme test.
2)préparation du réactif: dans un tube à essai, introduisons quelques millilitres d’une solution incolore de nitrate
d’argent. On ajoute de la soude 20 % pour former le précipité. Puis on ajoute de l'ammoniaque concentré, jusqu'à
dissolution du précipité, grâce à la formation de l’ion complexe incolore Ag(NH3)+2. On a le réactif de Tollens.

3
III Dosage de l’acétone.
L’Acétone est transformé en iodoforme par action d’un excès de diiode en milieu basique. On peut doser cet
excès de diiode pour connaître la concentration initiale de l’acétone. On dosera cet excès avec du thiosulfate de sodium.
(cette expérience est décrite dans le Bréal p 49-50)
matériel: matériel de dosage
produits: Acétone ; solution de diiode à 0,05 mol.L-1 dans KI à 0,05 mol.L-1 ; soude à 1 M ; H2SO4 dilué ; S2O32- à 0,1
mol.L-1 ; empois d’amidon.
5 mL de solution Acétonique (diluer au moins 100 fois la solution commercial à 99,7 %)
50 mL de solution de diiode à 0,05 mol.L-1 dans KI à 0,05 mol.L-1
soude à 1M (pour être en milieu basique)
CH3-CO-CH3 + 3I2 + 4OH- CH3COO- + CHI3(s) + 3I- + 3H2O
20 minutes à l’obscurité
25 mL d’H2SO4 dilué de façon à régénérer le I2 n’ayant pas réagi.
I- + IO- + 2H+ I2 + H2O
5I- + IO3- + 6H+ 3I2 + 3H2O
On titre le I2 en excès par S2O32- à 0,1 mol.L-1 en présence d’amidon.
Si on a le virage pour Veq.
quantité de matière diiode en excès:
n n Veq
IS O
22 3
2
05 05 01
, . , ,
( )
moles
quantité de matière de diiode au départ:
nI
03
2005 50 10 2 5
, . , . 10-3
moles
quantité de diiode ayant servi à oxyder l’acétone:
n n
II022
Or 1 mol d’Acétone nécessite 3 mol de I2 donc
n Veq
CH COCH
3 3 25 0 05 3 ( , . , . )/ 10-3
cn
CH COCH CH COCH
3 3
3 3
510 3
.
Remarque:
1) On ajoute de l’acide dilué car en milieu basique, le diiode se dismute en I- et IO3-. Le passage en milieu acide
régénère le I2
2) Le dosage se fait avec de l’empois d’amidon (solution aqueuse saturé d’amidon). La couleur passe du bleu à
l’incolore.
3) Il sera bon de vérifier la cohérence des résultats en sachant que la masse molaire de l’acétone est de 58 g.mol-1 et que
sa densité est d’environ 0,8
4) Il est conseillé de connaître le mécanisme de la réaction à l’iodoforme. Celui-ci est décrit dans de nombreux livres
dont le Bréal (montage de chimie, Tome 1) et le Vollhartd.
Conclusion:
Les Aldéhydes et les cétones se rencontrent fort souvent dans la nature: ils sont responsables en partie des
goûts et des arômes d’un bon nombre d’aliments et ils interviennent dans les mécanismes biochimiques de beaucoup
d’enzyme. En outre l’industrie consomme énormément d’aldéhydes et de cétones, tant comme réactifs que comme
solvants lors des synthèses. C’est pourquoi la liaison carbonyle est souvent considéré comme la fonction la plus
importante en chimie organique.
Nous avons essayé ici de présenter cette fonction, au travers diverses expériences montrant la nécessité de
définir deux classes de composés: les Aldéhydes et les cétones.
Note diverses
Formaldéhyde et Acétone sont les plus fabriqués. Le Formaldéhyde par oxydation du méthanol: production
d’environ 3 millions de tonnes aux Etats Unis.
CH OH CH O
O C Ag
3
600
2
2, ,

4
Le Formaldéhyde (en solution aqueuse: formol) sert de désinfectant et de fongicide. L’Acétone est produite à
environ 1 million de tonnes par an aux Etats Unis. Ce produit sert de solvants ou dans la synthèse d’autre produits.
1
/
4
100%