Page de pre*sentation d`une rone*o

UE11 – Parcours 3– Signalisation
Cellulaire – Cours n° 5
23/03/2016
Pr Vincent Goffin
vincent.goffin@inserm.fr
RT : Jérôme Langlois
RL : Alexandre Meunier
Récepteurs prolactine, hormone de croissance
et récepteurs cytokines
Plan :
1. Aspects moléculaires
A- Présentation des acteurs en présence (ligands, récepteurs)
B- Interaction ligand-récepteur : la première étape
C- Transmission du signal intracellulaire
2. Aspects physiopathologiques
A- Pathologies liées à des anomalies (génétiques) de signalisation
1. Défaut de signalisation
2. Excès de signalisation
B- Approches thérapeutiques
Abréviations :
Hormone de croissance : GH
Récepteur de l’hormone de croissance : GHR
Prolactine : PRL
Récepteur de la prolactine : PRLR
Lactogène placentaire : PL
Récepteur de cytokines hématopoïétiques de classe I : RCHCI
Facteur de croissance : GF
Mots du RT et du RL
Faites bien attention aux abréviations employées : elles peuvent être source de confusion. Ce sont celles
utilisées par le professeur pendant son cours ; il faut donc se familiariser avec !

I. Aspects moléculaires
A- Présentation des acteurs en présence (ligands, récepteurs)
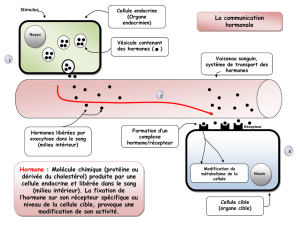
L’hormone de croissance (GH) et la prolactine (PRL) sont des hormones hypophysaires. Ces
deux hormones sont produites dans l’anté-hypophyse. La GH est produite par les cellules
somatotropes et la PRL est produite par les cellules lactotropes.
Ces deux hormones sont sous contrôle de multiples facteurs régulateurs, dont les principaux sont :
La dopamine qui inhibe la production de prolactine.
La somatostatine qui inhibe la production de GH.
La dopamine et la somatotropine sont produites dans l’hypothalamus.
La GH possède différentes fonctions :
Elle est impliquée dans la croissance et la morphogénèse des os et des tissus mous.
Elle est impliquée dans le métabolisme notamment à travers la lipolyse et la synthèse
protéique.
La prolactine est impliquée dans :
La lactation et la reproduction chez les mammaifères.
Le comportement et l’immunomodulation chez l’ensemble des vertébrés.
La balance eau-électrolytes surtout chez les poissons.
Les récepteurs de la GH et de la PRL sont largement exprimés dans un grand nombre de
tissus différents. Cela explique que ces hormones aient de nombreuses fonctions à travers tout
l’organisme.
La GH et la prolactine font partie d’une même famille, comprenant également le lactogène
placentaire (ou placental lactogen, PL). Le PL est une hormone ayant un rôle dans la reproduction,
comme la prolactine, à la différence près qu’il s’agit d’une hormone produite par le placenta. Elle est
de ce fait exclusive aux mammifères. Son rôle exact reste mal connu.
La GH et la PRL sont des hormones anciennes et conservées dans l’évolution. Il n’y avait à
l’origine qu’un seul gène ancestral, avant la divergence avant l’apparition des poissons qui ont déjà deux
gènes distincts PRL et GH.
De même, s’est mis en place, avec le temps, au sein des mammifères, deux types de PL :
Le PL des primates est issu du gène de la GH ;
Le PL des non-primates est issu du gène de la PRL.
Ces deux hormones ont a priori des fonctions similaires, mais possèdent un parcours
d’évolution différent. Ce phénomène s’appelle une convergence fonctionnelle.

La PRL et de la GH ont tous les deux une structure 3D qui leur est propre. Elles sont structurées
en faisceaux de 4 hélices α. Il s’agit de la signature structurale de la famille des cytokines
hématopoïétiques.
Les deux hormones sont virtuellement identiques et possèdent une structure similaire ; elles
comprennent ~200 acides aminés. Ces hormones peuvent subir des modifications post-
traductionnelles, à savoir phosphorylation, glycosylation, agrégation et protéolyse, lesquelles ont un
impact sur les propriétés biologiques des hormones.
On distingue des cytokines hématopoïétiques à longues chaînes et à courte chaîne :
Longues chaînes : GH, PRL, interférons…
Courtes chaînes : IL-2, IL-4, IL-5…
Il existe près d’une cinquantaine de membres dans la superfamille des récepteurs de
cytokines hématopoïétiques, répartis en deux classes :
Les récepteurs de classe I (GH/PRL).
Les récepteurs de classe II (interférons).
Les récepteurs de cytokines hématopoïétiques de classe I ont certaines caractéristiques particulières, à
savoir :
Leur partie N-ter est extracellulaire ; leur partie C-ter est intracellulaire.
Le domaine extracellulaire contient 4 Cystéines formant 2 ponts disulfures
intramoléculaires. Ces deux paires de cystéines sont primordiales pour maintenir la structure
de la partie extracellulaire du récepteur et ainsi assurer la liaison du récepteur à l’hormone
(ou cytokine).
Toujours dans le domaine extracellulaire du récepteur mais plus proche de la membrane, se
trouve un motif WS jouant un rôle dans l’adressage du récepteur à la membrane plasmique.
Ces motifs présentent des différences en fonction du ligand.
- Motif du récepteur de la PRL : Trp - Ser - X - Trp - Ser.
- Motif du récepteur de la GH : Tyr - Gly - X - Phe - Ser.
Du côté intracellulaire et proche de la membrane plasmique se situe une région riche en
proline, qui se nomme, la Boîte 1. Cette région est indispensable pour la transduction du
signal.
Toujours du côté intracellulaire, on trouve des motifs qui sont importants pour l’internalisation
du récepteur après exposition à la membrane afin d’être recyclé ou dégradé. On trouve un motif
d’interaction avec le système ubiquitine-protéasome, et un motif leucine-leucine.

La signature structurale des récepteurs de de cytokines hématopoïétiques de classe I est
caractérisée par la présence au niveau extracellulaire de deux feuillets β constitués chacun de 7 brins
β.
Il est important de préciser que chaque type de récepteur est codé par un seul gène. En
revanche, un même gène peut donner plusieurs isoformes de ce même récepteur, notamment à travers
l’épissage alternatif. Ainsi, dans le cas de PRLR, on distingue 5 isoformes avec une pertinence
physiologique, qui vont moduler l’activité de la protéine. La possibilité de création des isoformes est
permise par l’épissage alternatif des différents exons du gène de la PRLR.
Pour ΔS1, forme où les 2 PDS sont absents, on a une baisse de l’affinité pour la protéine.
Pour les formes S1a, S1b, ou encore intermédiaire, on a une baisse de la transmission du signal
du fait de la troncation de la partie C-terminale.
Enfin, pour la forme soluble, la partie intracellulaire est absente, le récepteur n’est pas ancré
dans la membrane plasmique. Il a été identifié dans le lait et le sérum et peut fixer la PRL.
Ainsi, il augmente la demi-vie de cette dernière, ce qui a fortiori, permet une durée d’action
plus longue.
Cystéines
Motifs WS
Boîte 1

B- Interaction ligand-récepteur : la première étape.
Il est important de préciser qu’il existe une spécificité de liaison des récepteurs aux hormones :
Le GHR ne fixe que la GH. Il est néanmoins possible de créer une PRL mutée liant le PRLR,
en mutant 6 acides aminés.
Le PRLR fixe la GH, le PL, la PRL. Il est néanmoins possible de créer une GH sans affinité
pour le PRLR en mutant 8 acides aminés.
Cette spécificité est donc due à une structure très localisée du récepteur.
Concernant le GHR, ses formes activables et activées sont des homodimères de récepteurs
simples, il est alors nécessaire de faire un regroupement des récepteurs. Les homodimères sont inertes
à la surface de la cellule et s’activent lors de la liaison à la GH. On distingue trois sites d’interaction
inter-moléculaires dans leur partie extracellulaire:
un site 1 entre une molécule de GHR et une face de la GH, site de haute affinité;
un site 2 entre l’autre molécule de GHR et la face opposée de la GH, site de de basse
affinité ;
on appelle site 3 le site d’interaction entre les deux molécules de récepteurs.
La GH induit un changement de conformation. On observe une rotation relative d’une des
deux chaînes de GHR par rapport à l’autre, ce qui va alors entraîner l’activation des voies de
signalisation.
Le GHR est constitué d’un seul type de chaînes (le GHR, homodimérisé), alors que d’autres
récepteurs de cytokines sont plus complexes. Il est possible de trouver des hétérodimères, des
hétérotrimères et d’autres choses encore. Il existe au sein de la superfamille des RCHCI des sous-
groupes dans lesquels on trouve une chaîne commune représentative du sous-groupe, et d’autres
chaînes spécifiques pour chaque membre du sous-groupe.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%