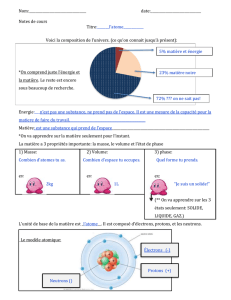
Modèle mathématique.

Examen Trimestriel 1
Année scolaire
2009-2010
MATIÈRE : Chimie
Prénom et nom:………………………………………………………
Date :
Classe : EB9
Durée : 60 minutes
Observations du professeur
:……………………………………………………………………………
Signature des parents :
…………………………………………………………………………….. prof:Batoul Hamouche
Remarque : 0.5 Pts sur la présentation
Exercice 1 (2.5 pts)
Un atome X possède 1 électron sur son niveau d’énergie N
a- Ecrire sa configuration électronique
b- A quelle période et à quelle colonne cet atome appartient – il ?
c- Déterminer son numéro atomique Z ?
d- Identifie X (nom et symbole)
e- Est – il un métal ?pourquoi ?
f- Déterminer son nombre de masse sachant qu’il possède 20 neutrons dans son noyau ?
g- Ecrire la représentation symbolique de l’isotope de X sachant qu’il contient 21 neutrons dans son
noyau ?
Exercice 2 (7pts)
On reconnait le soufre et le sodium par leurs cartes d’identité suivantes
a- Ecrire la configuration électronique de chacun et déduire le groupe, la colonne et la période :
b- Le soufre et le sodium tendent à saturer leurs niveaux externes pour acquérir la stabilité et
répondre à la règle de l’octet
1_ pourquoi le soufre et le sodium ne sont –ils pas stables ?
2- que comprendre par la règle de l’octet ?
3- comment ces 2 éléments peuvent –ils se saturer ?
4- quelle est la nature de la liaison qui se forme entre le sodium et le soufre ?
5- un échantillon de sodium a une masse de 460 u.m.a ; combien d’atomes de sodium renferme cet
échantillon ?
6- quelle est la quantité de matière qui se trouve dans 12. Atomes de soufre ?
Exercice 3 (6pts)
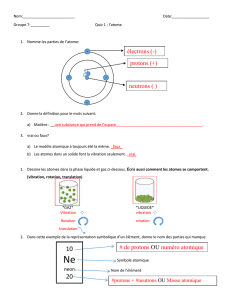
On considère deux atomes et appartenant au même élément X et de même configuration
électronique
a- Indiquer le nombre d’électrons que possèdent les atomes de l’élément X sur leur couche externe
b- Indiquer le nombre total d’électrons que possèdent les atomes de l’élément X en déduire le
numéro atomique Z et le symbole chimique
c- On donne les nombres de masse (= 35 et)= 37
1- Donner la constitution des atomes
NOTE :
17.5

2- Que représente par rapport à X ? Justifier
3- Sachant que les pourcentages atomiques de ces 2 atomes sont :
= 75 %
Calculer la masse atomique moyenne A de l’élément X
Exercice 4 (1.5pts)
Identifier les modèles illustrés ci - dessous, en donnant les caractéristiques de chaque modèle ?
1
/
2
100%